
| A、摩尔质量:g?mol-1 |
| B、密度:g?mL-1 |
| C、气体摩尔体积:L |
| D、阿伏加德罗常数:mol-1 |
科目:高中化学 来源: 题型:
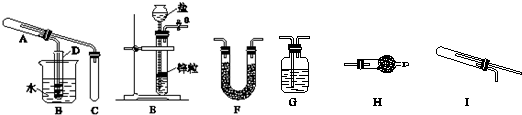
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2>Y2>Z2>W2 |
| B、Y2>W2>X2>Z2 |
| C、Z2>X2>W2>Y2 |
| D、W2>X2>Z2>Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
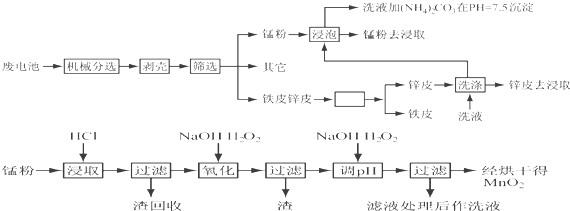
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+ |
| C、氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关性质或结构信息 |
| X | 基态原子的最外层电子排布式为nsnnpn |
| Y | 双原子分子单质在标准状况下密度为1.429g/L |
| Z | 所在周期的单核离子中半径最小 |
| W | 该元素原子有1个未成对的p电子 |
| T | 其单质和合金常用于航天工业和航海工业,其单质被誉为“21世纪金属”,其核外电子排布次外层电子数是最外层电子数的5倍 |
| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com