
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被还原 |
分析 A、不锈钢和铝合金等耐腐蚀;
B、金属作原电池的正极被保护;
C、酸性较强时Fe主要发生析氢腐蚀,中性或弱酸性发生吸氧腐蚀;
D、金属被腐蚀实质是金属失电子.
解答 解:A、不锈钢和铝合金等耐腐蚀,所以合金也可能耐腐蚀,故A错误;
B、金属作原电池的正极被保护,所以可以用原电池原理来减缓金属的腐蚀,故B错误;
C、酸性较强时Fe主要发生析氢腐蚀,中性或弱酸性发生吸氧腐蚀,所以钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同,故C正确;
D、金属被腐蚀实质是金属失电子,所以无论哪种类型的腐蚀,其实质都是金属被氧化,故D错误.
故选C.
点评 本题考查学生金属的腐蚀和防护知识,注意把握金属的腐蚀原理和防护方法,注意基本概念的理解和掌握是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 放热反应不需要加热就可以发生 | |
| B. | 反应条件为加热的反应都是吸热反应 | |
| C. | 化学反应放热还是吸热,取决于反应条件 | |
| D. | 化学反应除了生成新物质外,还伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于10s | B. | 等于10s | C. | 小于10s | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 酒精可用作燃料,说明酒精燃烧是释放能量的反应 | |
| C. | 干冰气化需要吸收大量的热,这个变化是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
; 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能含:SO42-、Br-、OH-、Ba2+ | |
| B. | 使紫色石蕊试液变红色的溶液中可能含:K+、Na+、Ba2+、HCO3- | |
| C. | 某溶液中,加铝粉有氢气放出,溶液中可能含:K+、Na+、H+、NO3- | |
| D. | 在c(H+)=10-14mol/L的溶液中可能含:Na+、AlO2-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
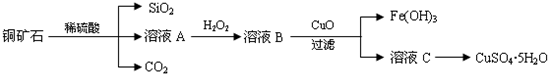
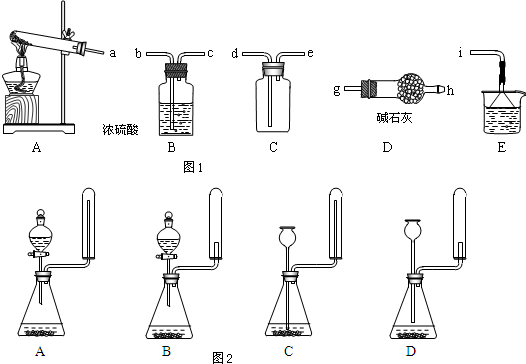
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1氨水中,c(OH-)与c(NH4+)相等 | |
| B. | 0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+) | |
| D. | 10mL0.02mol•L-1HCl溶液与10mL0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com