
�ں����ܱ�������ͨ��X��������Ӧ��2X(g)  Y(g)���¶�T1��T2��X�����ʵ�����Ũ��c(X)��ʱ��t�仯��������ͼ��ʾ��������������ȷ����
Y(g)���¶�T1��T2��X�����ʵ�����Ũ��c(X)��ʱ��t�仯��������ͼ��ʾ��������������ȷ����
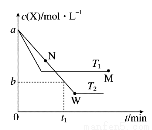
A���÷�Ӧ���е�M��ų�������С�ڽ��е�W��ų�������
B��T2�£���0��t1ʱ���ڣ�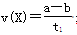 mol��L��1��min��1
mol��L��1��min��1
C��M�������Ӧ����v������N����淴Ӧ����v��
D��M��ʱ�ټ���һ����X��ƽ���X��ת���ʼ�С
 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016����������ɽ���и������Ĵ�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���Һ�У��������ʵ���Ũ�ȹ�ϵ������ȷ����
A��0.1 mol��L��1 Na2CO3��Һ�У�c(Na��)��c(HCO3��)��c(H2CO3)��2c(CO32��)
B��pH��12��Ba(OH)2��Һ��pH��12��Na2CO3��Һ�У�ˮ�����c(H��)���
C����0.2 mol��L��1 NaA��Һ��0.1 mol��L��1������Һ�����������ü�����Һ��
c(Na��)��c(H��)��c(A��)��c(Cl��)
D�������£�pH��4�Ĵ�����pH��10��NaOH��Һ�������Ϻ�pH<7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ͨ����ʵ������Ĺ۲졢���������ó���ȷ�Ľ����ǻ�ѧѧϰ�ķ���֮һ��������ʵ����ʵ�Ľ�����ȷ����
�������� | �� �� | |
A | KI������Һ��ͨ��Cl2����Һ���� | Cl2������۷�����ɫ��Ӧ |
B | ŨHNO3�ڹ��������±�� | ŨHNO3���ȶ���������ɫ����������Ũ���� |
C | ij��Һ�м��������ữ���Ȼ�����Һ���а�ɫ�������� | ˵������Һ�к���SO42�� |
D | ͭƬ����Ũ�����У������Ա仯 | ˵��ͭ�����Ũ�����з����ۻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�������18mol/L��Ũ�����м������ͭƬ�����ȣ�����ԭ��H2SO4Ϊ0.9mol����μӷ�Ӧ��Ũ�����ʵ�����Ϊ
A������50mL B������50mL C������100mL D������100mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������ˮ�����г�����ɱ��������HClO��ɱ��������ClO��ǿ��25��ʱ����-��ˮ��ϵ�д�������ƽ���ϵ��
Cl2��g��  Cl2��aq�� K1=10��1.2
Cl2��aq�� K1=10��1.2
Cl2��aq��+ H2O  HClO + H+ +Cl�� K2=10��3.4
HClO + H+ +Cl�� K2=10��3.4
HClO  H+ + ClO�� Ka=?
H+ + ClO�� Ka=?
���У�Cl2(aq)��HClO��ClO���ֱ�����������ռ������������pH�仯�Ĺ�ϵ��ͼ��ʾ�����б�����ȷ����
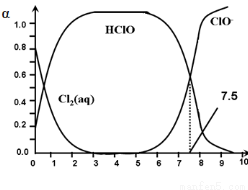
A���ȴ�������ˮʱ�����ļ���ɱ��Ч�����ڶ�����
B�����ȴ�������ˮʱ��pH=7.5ʱɱ��Ч����pH=6.5ʱ��
C�����ȴ���ˮ��ϵ�У�c(HClO) +c(ClO��) =c(H+)��c(OH��)
D��Cl2��g��+ H2O  2H+ + ClO�� + Cl�� ��K=10��12.1
2H+ + ClO�� + Cl�� ��K=10��12.1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£�ij�����м���������̼��ƣ�������ӦCaCO3(s) CaO(s)+CO2(g)�� �ﵽƽ�⣬����˵����ȷ����
CaO(s)+CO2(g)�� �ﵽƽ�⣬����˵����ȷ����
A���������СΪԭ����һ�룬����ϵ�ٴδﵽƽ��ʱ��CO2��Ũ��Ϊԭ����2��
B�����������Ϊԭ����2�����ٴδﵽƽ��ʱ��������ܶȱ�С
C��CaCO3(s)���ȷֽ�����CaO(s)��CO2(g)����S<0
D����������������䣬����He��ƽ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ����5����ģ��ѧ�Ծ��������棩 ���ͣ������
ͭ���仯�����ڹ�ũҵ�������ճ�������Ӧ�÷dz��㷺.
��1������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
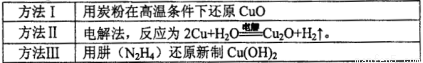
�ٹ�ҵ�ϳ��÷�����ͷ�������ȡCu2O�������÷���I����ԭ����____________��
����֪��
2Cu(s)+1/2O2(g)�TCu2O(s)��H=-169kJ•mol-1��
C(s)+1/2O2(g)�TCO(g)��H=-110.5kJ•mol-1��
Cu(s)+1/2O2(g)�T2CuO(s)��H=-157kJ•mol-1
��I�����ķ�Ӧ��2CuO(s)+C(s)=Cu20(s)+CO(g)�� ��H=____________kJ/mol��
��2���⻯��ͭ��һ�ֺ�ɫ���壬�������з�Ӧ�Ʊ���4CuSO4+3H3PO2+6H2O=4CuH��+4H2SO4+3H3PO4��
�÷�Ӧÿת��3mol���ӣ�����CuH�����ʵ���Ϊ____________��
��3���Ȼ�ͭ��Һ��ͭ�����ֵķֲ�����(ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ���)��c(Cl-) �Ĺ�ϵ��ͼ��ʾ��
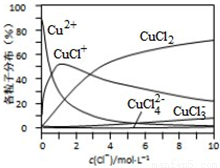
�ٵ�c(Cl-)=9mol•L-1ʱ����Һ����Ҫ��3�ֺ�ͭ����Ũ�ȴ�С��ϵΪ____________��
����c(Cl-)=1mol•L-1���Ȼ�ͭ��Һ�У�����AgNO3��Һ����ͭ���ּ�ת�������ӷ���ʽΪ____________(��дһ��)��
��4����֪��Cu(OH)2�Ƕ�Ԫ���������(H3PO3)�Ƕ�Ԫ���ᣬ��NaOH��Һ��Ӧ������Na2HPO3��
����ͭ����Һ��Cu2+����ˮ�ⷴӦ��ƽ�ⳣ��Ϊ____________��(��֪��25��ʱ��Ksp[Cu(OH)2]=2.0��10-20mol3•L-3)
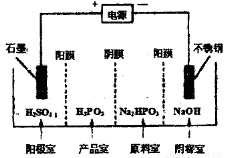
�ڵ��Na2HPO3��Һ�ɵõ������ᣬװ����ͼ(˵������Ĥֻ����������ͨ������Ĥֻ����������ͨ��)�����Ʒ���з�Ӧ�����ӷ���ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ����5����ģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ���������ͬһԭ�����͵���
A����ˮ�ֱ����ֲ���ͺ��ѻ������У���ˮ����ɫ
B��Ʒ����Һ�зֱ�ͨ��SO2��Cl2��Ʒ�����ɫ
C����������Һ�зֱ����NaCl��Һ��HgC12��Һ�����й�������
D���ֱ����ʢ��NH4Cl�͵��ʵ���Թܣ��ܿھ��й�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɹź�������ܶ���ѧ�߶������л�ѧ���������棩 ���ͣ�ѡ����
��100 mL 0.001 mol��L��1�������50 mL pH��3��������Һ��Ϻ�������Һ��pHΪ( )
A��4.5 B��2.7 C��3.3 D��3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com