

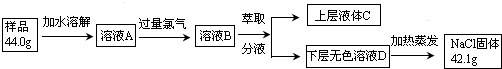

分析 海水经淡化后母液中含有溴离子,通入氯气,可得到低浓度的溴,然后通入空气吹出,进行富集,用碱溶液吸收,再通入氯气可得到浓度较大的溴,
(1)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,同时生成了氢氧化钠;
(2)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(3)若食盐样品中混有NaBr杂质,加水溶解后通入氯气,经萃取分液后得到氯化钠溶液和溴的四氯化碳溶液,对氯化钠溶液进行蒸发结晶,得到氯化钠固体,根据氯化钠和样品的质量,可得到该食盐样品的纯度,实验室用浓盐酸和二氧化锰在加热条件下反应生成氯气,用丙进行除杂;
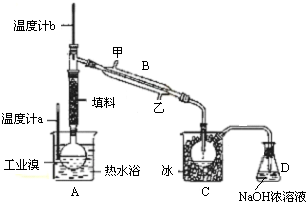
(4)①蒸馏时,为充分冷凝,冷凝水应从下端进,上端出;
②因溴具有强氧化性和腐蚀性,应避免使用橡皮管;
③实验用蒸馏的方法分离,要达到提纯溴的目的,应控制好实验温度;
④可用溴化钠除氯.
解答 解:(1)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,同时生成了氢氧化钠,
故答案为:氢气、烧碱;
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:富集溴元素;
(3)若食盐样品中混有NaBr杂质,加水溶解后通入氯气,经萃取分液后得到氯化钠溶液和溴的四氯化碳溶液,对氯化钠溶液进行蒸发结晶,得到氯化钠固体,根据氯化钠和样品的质量,可得到该食盐样品的纯度,该实验方法为定量法中的重量法,实验室用浓盐酸和二氧化锰在加热条件下反应生成氯气,用丙除去氯化氢,然后在丙中反应,尾气也可用丙处理,
故答案为:重量;甲;丙;丙;
(4)①由装置图可知,提纯溴利用的原理是蒸馏,仪器B为冷凝管,冷凝水应从下端进,即从乙进,控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色的液态溴单质,同时避免污染环境,最后进行尾气吸收,
故答案为:冷凝管;甲;
②由于溴单质是一种强氧化剂,易腐蚀橡胶制品,所以整套装置不能用橡胶塞和橡胶管,
故答案为:溴蒸气对橡胶有腐蚀作用;
③达到提纯溴的目的,操作中应控制的关键条件是把温度控制在溴的沸点59°C,并收集该温度下的馏分,
故答案为:控制好水浴温度;
④C中收集的液体为溴,颜色为红棕色,除去氯气,可用NaBr,
故答案为:红棕色;NaBr.
点评 本题考查物质的分离、提纯,侧重海水资源的综合利用,涉及到海水淡化、海水提溴工艺、萃取等知识点,注意物质的分离、提纯应把握物质的性质的异同,掌握从海水中提取食盐和溴的原理为解答该题的关键,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种元素组成的分子中一定只有极性键 | |
| B. | 含有阴离子的化合物一定有阳离子 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 离子化合物的熔点一定比共价化合物的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0oC,1.01×106Pa时,11.2L氧气所含的氧原子数为NA | |
| B. | 标准状况下,80gSO3所占的体积约为22.4L | |
| C. | 31g白磷分子中,含有的共价单键数目是NA | |
| D. | 0.5 mol Na2O2中含有的阴离子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com