
 制取氨气并完成喷泉实验
制取氨气并完成喷泉实验分析 (1)实验室用加热氯化铵、氢氧化钙的方法制取氨气;
(2)依据氨气密度小于空气密度,极易溶于水的物理性质选择收集方法;氨气为碱性气体,应选择碱性干燥剂;
(3)利用氨气极易溶于水,形成压强差而形成喷泉;
(4)氨水中含有电解质一水合氨和水,二者都是弱电解质,依据电离平衡过程分析溶液中含有微粒.
解答 解:(1)氯化铵、氢氧化钙加热生成氨气、氯化钙和水,化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气密度小于空气密度,极易溶于水,所以应选择向下排空气法;氨气为碱性气体,应选择碱性干燥,碱石灰为碱性干燥剂,可以干燥氨气;
故答案为:向下排空气法; 碱石灰;
(3)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,大气压将烧杯中的水压入烧瓶,而形成喷泉;
故答案为:打开止水夹,挤出胶头滴管中的水;氨气极易溶于水,烧瓶内的氨气溶于少量水,使烧瓶内压强迅速减小,大气压将烧杯中的水压入烧瓶;
(4)氨水中存在化学平衡:NH3+H2O?NH3•H2O?NH4++OH-;H2O?H++OH-溶液中存在三种分子:NH3、H2O、NH3•H2O;三种离子:NH4+、OH-、H+;
故答案为:NH3、H2O、NH3•H2O; NH4+、OH-、H.
点评 本题考查了氨气的制备和收集及性质的检验,明确制备原理和喷泉实验的原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| C. | 3.0 mol SO2+0.5 mol O2+1.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在FeCl3溶液中加入NaOH溶液 | B. | 加热煮沸FeCl3溶液 | ||
| C. | 把FeCl3溶液滴入沸水中 | D. | 把饱和的FeCl3溶液滴入到沸水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不确定 | B. | 变小 | C. | 不变 | D. | 变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维中所用材料为晶体硅 | B. | 水玻璃可用作木材防火剂 | ||
| C. | 氯气可用于自来水的杀菌消毒 | D. | Fe2O3可以做油漆的颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
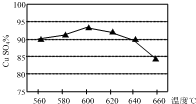 将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com