
【题目】写出BaCl2与Na2SO4溶液反应的化学方程式:____________。
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某同学对有关物质进行的分类:

(1)每组分类均有错误,其错误的物质分别是__________、__________、____________(填化学式)。
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是__________________(填化学式);
②“三酸”与“两碱”之间均可反应,请用化学方程式表示硫酸与烧碱和纯碱的反应:______________________________、__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种常用的植物调味油,工业上可按如下路线合成。
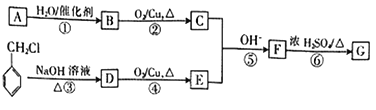
已知:
①有机物A是分子中单键与双键数目之比为4∶1的烯烃;
②G的分子式为C9H8O,能发生银镜反应;
③CH3CHO+CH3CHO![]()
![]() 。
。
回答下列问题:
(1)B的名称为__________,F中含有的官能团的名称是__________。
(2)E的结构简式为__________,G的结构简式为________________。
(3)⑤的反应类型为__________,⑥的反应类型为__________。
(4)反成③的化学方程式为_____________________________。
(5)反应①~⑥中符合原子经济性(原子利用率为100%)的是__________ (填序号)。
(6)同时符合下列条件的F的同分异构体有__________种,其中核磁共振氢谱显示有四组峰,且峰面积之比为3∶3∶2∶2的是__________ (填结构简式)。
a.苯环上含有两个取代基 b.分子中含有-COO-结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行如下了实验。
利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量。
实验装置如图所示。

(1)a的作用是____________,仪器d的名称是________________ 。
(2)检查装置气密性:____________(填操作),关闭k,微热c,导管e末端有气泡冒出;停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。
(3)c中加入一定体积高氯酸和mg氟化稀土样品,Z中盛有滴加酚酞的NaOH溶液。加热b、c,使b中产生的水蒸气进入c。
①下列物质可代替高氯酸的是_________(填序号)。
A.硝酸 B.盐酸 C.硫酸 D.磷酸
②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成。若有SiF4生成,实验结果将__________(填“偏高”“ 偏低”或“不受影响”)。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是______________。
(4)向馏出液中加入V1mL c1mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2mol·L-1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2ml,则氟化稀土样品中氟的质量分数为______________。
(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏时间),测量并计算出氟元素质量,重复多次。该操作的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应X2(g)+H2(g)![]() 2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A. 5% B. 17% C. 25% D. 33%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是

A. 甲、乙中电解质溶液的pH都增大
B. 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
C. 乙中电解MgCl2溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D. 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =![]() +7H2O
+7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况}。向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是
A. 该合金中铜与铁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C. 得到2.54g沉淀时,加入NaOH溶液的体积是600mL
D. NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com