
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
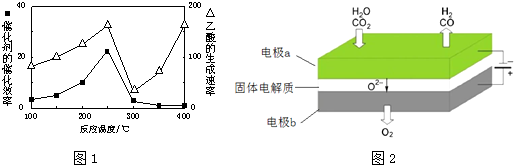
分析 (1)①先利用三段法求出各物质的物质的量,然后再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
②根据盖斯定律来解答;
(2)①根据温度对催化剂活性的影响;
②根据外界条件对化学平衡的影响,平衡正向移动,反应物转化率增大;
③先将Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性;
(3)二氧化碳为酸性气体,Li2O、Na2O、MgO均能吸收CO2与氧化性无关;
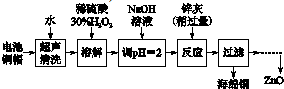
(4)二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子.
解答 解:(1)①CO2(g)+CH4(g)?2CO(g)+2H2(g).
起始(mol) 6 6 0 0
反应(mol) x x 2x 2x
平衡(mol) 6-x 6-x 2x 2x
由CH4的体积分数为0.1,则$\frac{6-x}{12+2x}$=0.1,解得X=4,所以K=$\frac{[CO]^{2}•[{H}_{2}]^{2}}{[C{O}_{2}]•[C{H}_{4}]}$=$\frac{{2}^{2}×{2}^{2}}{0.5×0.5}$=64,
故答案为:64;
②已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
②CO(g)+H2O (g)=CO2(g)+H2 (g)△H=+2.8kJ•mol-1 ②
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=-890.3kJ•mol-1+2.8kJ•mol-1×2+566.0kJ•mol-1×2=+247.3 kJ•mol-1,
故答案为:+247.3 kJ•mol-1;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;
②增大容器体积减小压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,故答案为:增大体积减小压强或增大CO2的浓度;
③Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
(3)a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;
b.Li2O、Na2O、MgO均能吸收CO2,钠、镁、铝为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;
c.Li2O、Na2O、MgO均能吸收CO2,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;
故答案为:ab;
(4)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,故答案为:CO2+2e-═CO+O2-.
点评 本题主要考查了综合利用CO2,涉及热化学反应、电化学、化学平衡影响因素等,较为综合,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | NaOH、NaCl、HCl、Na2SO4 | B. | NaCl、Na2SO4、NaOH、HCl | ||
| C. | NaCl、NaOH、Na2SO4、HCl | D. | Na2SO4、NaOH、NaCl、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )| A. | 铊的元素符号为Tl | B. | 铊原子的中子数=204-81=123 | ||
| C. | 铊位于第六周期ⅢA族 | D. | 铊的金属性比铝的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同的条件下,2mol氢气与1 mol氧气的总能量小于2mol 水蒸气的总能量 | |
| B. | H2(g)+$\frac{1}{2}$ O2(g)→H2O(1)+Q1;Q1>241.8kJ | |
| C. | 氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | |
| D. | 任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| B. | 乙醇、次氯酸钠和二氧化硫分别属于非电解质、强电解质和弱电解质 | |
| C. | Na、Al、Cu通常分别用电解法、热分解法和置换法冶炼得到 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:| 序号 | 35mL试剂 | 固体 | 混合温度前/℃ | 混合温度后/℃ |
| ① | 水 | 2.5gNaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2gNa2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5gNaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2gNa2CO3 | 20.0 | 25.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com