
 诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )
诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )| A. | 能与氢气反应 | B. | 能与金属钠反应 | ||
| C. | 能与NaOH溶液反应 | D. | 不能与新制Cu(OH)2悬浊液反应 |
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
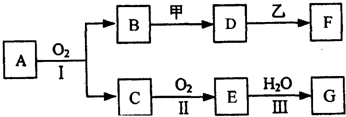
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 3 | ① | ③ | ④ | ⑨ | ||||
| 4 | ② |
 .
.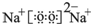 ,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA
,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | 仅②③ | C. | 仅① | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
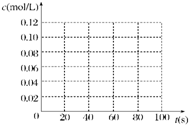 在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)(mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
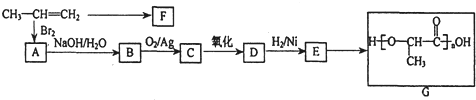
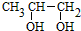 ,D
,D ;
; ;
;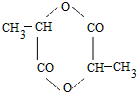 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 | |
| B. | 容量瓶刚用蒸馏水洗净,没有烘干 | |
| C. | 定容时,加蒸馏水先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 | |
| D. | 定容时仰视刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com