
【题目】某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产三氯乙醛(CCl3CHO)的方法,由乙醇与氯气作用,制得三氯乙醛。
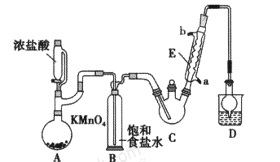
查阅资料,有关信息如下:
①制备反应原理:![]()
可能发生的副反应:![]()
![]()
②相关物质的相对分子质量及部分物理性质:
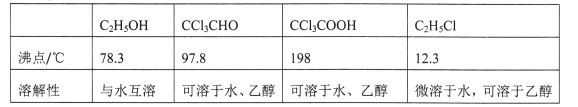
(1)仪器C和E的名称分别是____,____。
(2)仪器A中发生反应的离子方程式为____ 。
(3)该装置C最好采用____加热的方法,以控制反应温度在70℃左右。
(4)该设计流程中存在一处缺陷,该缺陷可能引起的后果是________。
(5)反应结束后,从C中的混合物中分离出CCl3COOH的方法是_____(填名称)。
【答案】 三颈瓶(或三口瓶) (球形)冷凝管 2MnO4- + 10Cl- + 16 H+ = 2Mn2+ + 5Cl2↑+ 8H2O 水浴 引入杂质C2H5Cl 和 CCl3COOH 蒸馏
【解析】
本题考查有机物制备。A装置利用高锰酸钾溶液与浓盐酸制备氯气,B装置用饱和食盐水除去氯气中的HCl,C装置氯气与乙醇反应中反应制备CCl3CHO,D装置盛放氢氧化钠溶液,吸收尾气中氯气和HCl,防止污染空气。
(1)根据仪器构造可知C是三颈烧瓶、E是球形冷凝管;(2)仪器A中高锰酸钾溶液与浓盐酸制备氯气,反应中高锰酸钾做氧化剂被还原为氯化锰,氯化氢做还原剂被氧化为氯气,反应的离子方程式为:MnO4- + 10Cl- + 16 H+ = 2Mn2+ + 5Cl2↑+ 8H2O;(3)装置C中控制反应温度在70℃左右,应采取水浴加热,达到受热均匀,偏于控制温度的目的;(4)由题给装置可知,生成的氯气中含有水蒸气,氯气能与水反应生成HCl与HClO,HCl和HClO能与乙醇发生副反应生成C2H5Cl和CCl3COOH,应在装置B和C之间增加一个干燥装置,除去氯气中的水蒸气;(5)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是ClO-和Cl-,在75℃以上、浓碱溶液中主要产物是ClO3-和Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。

a为浓盐酸,b为MnO2,c为饱和食盐水,d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。
①装置I中反应的离子方程式为_______________。
②若取消装置II,对本实验的影响是_______________。
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是_______________。
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和______________。
(2)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。 (2S2O32-+I2=S4O62-+2I-)
①步骤2中除去C1O-的离子方程式是_____________。“煮沸”的目的是_________。
②比较碱性条件下氧化性ClO3-_______C1O-(填写“>”或“<”)。
③样品中KClO3的貭量分数为________。(答案保留三位有效数字,KClO3式量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基香草醛(3-乙氧基-4-羟基苯甲醛)是一种广泛使用的可食用香料。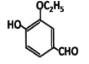 与乙基香草醛互为同分异构体,遇FeCl3溶液显紫色,且苯环上只有两个侧链的酯类的同分异构体种类有( )
与乙基香草醛互为同分异构体,遇FeCl3溶液显紫色,且苯环上只有两个侧链的酯类的同分异构体种类有( )
A. 6种 B. 15种 C. 18种 D. 21种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是(______)
A.铁在冷的浓硝酸中钝化 B.生铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为________________________________
(3) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:_________________________________
②发生氧化反应的物质是________,反应中4 mol的氧化剂能________(填“失去”或“得到”)________ mol电子。
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为________。
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:
2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为___________。
②高铁酸钠在水中可以发生如下反应:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为_______________________________________________________
③下列物质能作净水剂(能除去水中的悬浮物)的有____________。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是
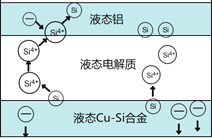
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采取CO(g)和H2(g)合成CH3OH(g)
(1)已知某温度和压强下
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
③2CH2OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
则在相同温度和压强下,CO(g)与H2(g)合成CH3OH(g)的热化学方程式__________。若反应生成6.4g甲醇,则转移电子的物质的量为__________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
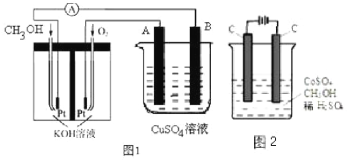
①写出燃料电池负极的电极反应式__________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是__________极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为__________L。
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后将甲醇氧化成CO2和H+(用石墨烯除去Co2+)现用如图2所示装置模拟上述过程,则Co2+在阳极的电极反应式为__________。除去甲醇的离子方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com