
| A. | 12g金刚石中所含的共价键数为4NA | |
| B. | 标准状况下,11.2L SO3所含的氧原子数为1.5NA | |
| C. | 常温下,1L0.1mol/L的NH4NO3溶液中铵根离子为0.1 NA | |
| D. | 1mol 过氧化氢分解转移NA电子 |
分析 A、求出金刚石的物质的量,然后根据1mol金刚石中含2mol共价键来分析;
B、标况下三氧化硫为固体;
C、铵根离子为弱碱阳离子,在溶液中会水解;
D、过氧化氢分解反应为歧化反应.
解答 解:A、12g金刚石的物质的量为1mol,而1mol金刚石中含2mol共价键,故含2NA条共价键,故A错误;
B、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和含有的氧原子个数,故B错误;
C、铵根离子为弱碱阳离子,在溶液中会水解,故溶液中铵根离子个数小于0.1NA个,故C错误;
D、过氧化氢分解反应为歧化反应:2H2O2=2H2O+O2↑,此反应中,1mol双氧水分解转移NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 17.4g某硫化磷(如图) 中含P-S键数目为0.6NA 中含P-S键数目为0.6NA | |
| C. | 每个分子中含8个碳原子的某烃,1mol烃中含碳碳单键的个数最多为7NA | |
| D. | 标准状况下,22.4LSO2与O2的混合气体,含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量 | |
| B. | 1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量 | |
| C. | 1 mol H2(g)与1 mol I2(g)完全反应生成 2 mol的HI气体需吸收52 kJ的热量 | |
| D. | 1 mol H2(g)与1 mol I2(g)完全反应放出26 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
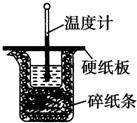 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| B. | 若反应物的总能量大于生成物的总能量,则该化学反应为释放能量的反应 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 若反应X+Y=M是放热反应,该反应一定不用加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
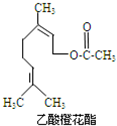 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | ①②③ | B. | ①②⑤ | C. | ①②⑤⑥ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com