
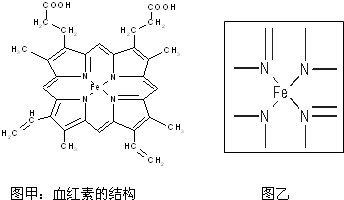
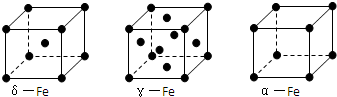
 ,若都为单键,则该氮原子为sp3杂化;
,若都为单键,则该氮原子为sp3杂化; ;
; ;
; ,若都为单键,则该氮原子为sp3杂化,如NH4+,
,若都为单键,则该氮原子为sp3杂化,如NH4+,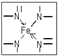 ;
;| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 4 |
| 3 |
| 4 | ||
|
4
| ||
| 3 |
4
| ||
| 3 |
2×
| ||||
(
|
2×
| ||||
(
|


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
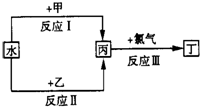
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能量守恒原理 |
| B、泡利不相容原理 |
| C、洪特规则 |
| D、近似能级图中的顺序3d轨道能量比4s轨道高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离核较近区域运动的电子能量较高 |
| B、M层最多容纳的电子数不超过8 |
| C、K层为最外电子层时最多只能容纳8个电子 |
| D、稀有气体元素的原子形成了稳定的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用NaOH溶液除去乙酸乙酯中混有的少量乙酸和乙醇 |
| B、可用水区别四种有机溶剂:苯、四氯化碳、己烯、无水乙醇 |
| C、淀粉水解的最终产物能与新制的氢氧化铜悬浊液反应生成砖红色的沉淀 |
| D、蒸馏“地沟油”可以获得甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
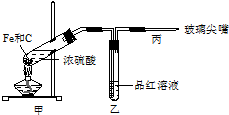 (1)下列仪器在使用前必须检查其是否漏水的是
(1)下列仪器在使用前必须检查其是否漏水的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Ba2+、NO3-、Cl- |
| B、Cl-、SO42-、Na+、K+ |
| C、SO42-、NO3-、Fe2+、Mg2+ |
| D、Na+、K+、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com