
| A、Al2(SO4)3 |
| B、NaOH |
| C、BaCl2 |
| D、FeCl2 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
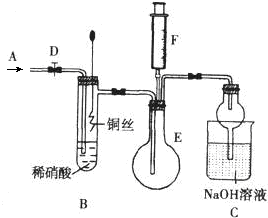 为探究铜与稀硝酸反应产生的气体主要是NO,某课外活动小组设计了下列实验.图中D为止水夹,F是装有一半空气的注射器,其中加热装置和固定装置均已略去.请回答有关问题:
为探究铜与稀硝酸反应产生的气体主要是NO,某课外活动小组设计了下列实验.图中D为止水夹,F是装有一半空气的注射器,其中加热装置和固定装置均已略去.请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解度(S) |
| B、溶质的质量分数(w) |
| C、物质的量浓度(c) |
| D、摩尔质量(M) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
| 阴离子 | SO42-、OH-、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com