
下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是( )

A
【解析】
试题分析:A.Fe2+、NO3-在中性环境可以大量共存,在酸性环境中Fe2+会被硝酸氧化为Fe3+,而硝酸则被还原为NO,书写的离子方程式符合反应事实和离子方程式的原则,正确;B.Ca2+、HCO3-、Cl-可以大量共存,当向其中加入少量的NaOH溶液时发生反应应该以不足量的NaOH为标准,离子方程式是:Ca2++HCO3-+OH-=CaCO3↓+H2O;错误;C.K+、AlO2-、HCO3-不可以大量共存,会发生反应:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,错误;D.NH4+、Al3+、SO42-可以大量共存,当加入少量的Ba(OH)2溶液时,会发生反应应该以Ba(OH)2为标准,反应的离子方程式是: 2Al3++3SO42-+3Ba2++6OH-=2 Al(OH)3↓+3BaSO4↓.错误。
考点:考查离子共存及离子方程式书写的正误判断的知识。


科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2;
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是
A.两个反应中生成等量的I2时转移的电子数相等
B.I2在反应①②中都是氧化产物
C.NaI和NaIO3在一定条件下能反应生成I2
D.NaIO3在任何化学反应中只能作氧化剂,不能作还原剂
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:填空题
(10分 )工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
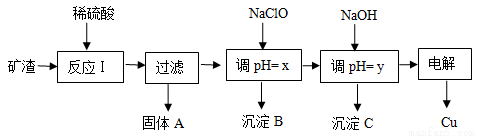
已知: Cu2O + 2H+ = Cu + Cu2+ + H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)反应I中如果Cu2O与Fe2O3之间恰好发生氧化还原反应,则反应的化学方程式为:___________________________________________________________________________
(2)用NaClO调pH=x是此工艺流程中的最佳选择。
①选择NaClO的理由是:____________________________________________________
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
_________________________________________________________________________
(3)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol·L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为 ____。(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(4)电解初期阳极的电极反应式为________________________________
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是 ( )
A.氯化铝溶液中加入过量氨水 :Al3+ + 4NH3·H2O = [Al(OH)4]- + 4NH4+
B.澄清石灰水与过量苏打溶液反应: Ca2+ + HCO3-+ OH-= CaCO3↓+ H2O
C.碳酸钙溶于醋酸 CaCO3 + 2H+=Ca2+ +CO2↑+ H2O
D.氯化亚铁中通入氯气 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:填空题
(9分)工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的工艺流程如图所示:
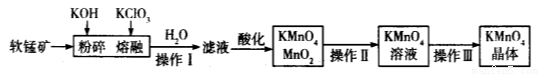
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。下列酸能用于酸化高锰酸钾溶液的是____________(填序号)。
A.盐酸 B.稀硫酸 C.硝酸 D.氢硫酸
(2)操作Ⅰ、Ⅱ、Ⅲ的名称分别是______________、_______________、_______________。
(3)软锰矿与过量固体KOH和KClO3在熔融状态下反应时的氧化剂是__________(填化学式)。反应后加水溶解得到的滤液中主要含有KCl和K2MnO4,则滤液酸化时发生反应的离子方程式为______________。
(4)已知KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2。取上述制得的KMnO4产品0.33 g,恰好与0.67 g Na2C2O4完全反应,则KMnO4的纯度为___________________%。
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有SO42-和N4H44+两种离子,当N4H44+遇到碱性溶液时,会生成N4分子。下列说法正确的是( )
A.14N、N4与N2互为同位素
B.N4H4(SO4)2的电离方程式为N4H4(SO4)2 N4H44++2 SO42-
N4H44++2 SO42-
C.N4H4(SO4)2不能与草木灰、K3PO4等化肥混合施用
D.N4H4(SO4)2中只含有共价键,不含离子键
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质能使紫色石蕊试液由紫色变红又褪色的是
①Cl2 ②盐酸 ③氯水 ④盐酸酸化的漂白粉 ⑤木炭 ⑥Na2O2
A.①③④ B.①②③⑥ C.②③④ D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(10分)最近雾霾天气肆虐我国大部分地区,其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是 。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7,H2CO3的电离常数为K1=4.30×10-7,K2=15.60×10-11,则下列微粒可以大量共存的是 (填序号)
A.CO32- 、HSO3- B.HSO3- 、HCO3- C.SO32- 、HCO3- D.HCO3-、H2SO3
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显 性,试解释原因
②在NaHSO3溶液中离子浓度关系不正确的是
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(H2SO3)+c(H+)= c(SO32-)+c(OH-)
C.c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-)
D.c(H+)+ c(Na+)=2c(SO32-)+c(HSO3-)+ c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com