
下列说法中正确的是( )
|
| A. | 难溶电解质的Ksp越小,溶解度就一定越小 |
|
| B. | 一般认为沉淀离子浓度小于1.0×10﹣5 mol/L时,沉淀就达完全 |
|
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) |
|
| D. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 |
| 难溶电解质的溶解平衡及沉淀转化的本质. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | A、Ksp越小,电解质的溶解度不一定越小,溶度积常数与温度有关系,与溶液类型以及浓度无关; B、沉淀不可能完全沉淀,当离子浓度小于1.0×10﹣5mol/L时,可认为沉淀完全; C、如满足Qc>Ksp,可生成沉淀; D、溶度积常数与温度有关系,与溶液类型以及浓度无关. |
| 解答: | 解:A、Ksp越小,电解质的溶解度不一定越小,溶解度还取决于溶液的类型和浓度关系,以及物质的摩尔质量等因素,例如AgCl在水中和盐酸中的溶解度不同,但溶度积相同,故A错误; B、沉淀不可能沉淀完全,当离子浓度小于1.0×10﹣5mol/L时,可认为沉淀完全,故B正确; C、BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀,是因为碳酸根离子浓度大,和钡离子浓度乘积等于碳酸钡的Ksp,实际Ksp(BaSO4)小于Ksp(BaCO3),故C错误; D、溶度积常数与温度有关系,与溶液类型以及浓度无关,故D错误; 故选B. |
| 点评: | 本题考查了沉淀的溶解平衡的相关知识,注意绝对不溶的物质是没有的,满足Qc>Ksp,可生成沉淀,题目难度不大. |


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
下列推断正确的是( )
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.SO2和NO2都是酸性氧化物,都能与水反应生成酸
B.Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同
C.Al2O3和Na2O按物质的量比1:1投人水中可得到澄清溶液
D.金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行
B.吸热反应能自发进行的原因是从外界获得了能量
C.SiO2常温下可以与NaOH溶液和HF溶液反应,说明其具有两性
D.反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2), 某小组同学设计了如图所示装置(夹持仪器和连接用的乳胶管已经省略)。
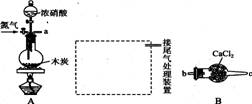

(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为a→( )( ) →( )( ) →( )( ) →( )( )(填仪器接口的字母编号)。连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通人氮气的主要目的是 。
(2)简述使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作: 。装置E中观察到的主要实验现象有 。
(3)装置C的作用是 。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成: (写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
|
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将Na2CO3和NaHCO3混合物〔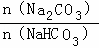 =a a≤3〕溶于水制得稀溶液,下列有关该溶液中微粒的物质的量浓度关系正确的是( )
=a a≤3〕溶于水制得稀溶液,下列有关该溶液中微粒的物质的量浓度关系正确的是( )
|
| A. | a=1则c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+) |
|
| B. | a=2则c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3) |
|
| C. | a为任意值时,则c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣) |
|
| D. | a=0则c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不正确的是( )
|
| A. | 某特定反应的平衡常数仅是温度的函数 |
|
| B. | 催化剂不能改变平衡常数的大小 |
|
| C. | 平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
|
| D. | 化学平衡发生移动,平衡常数必发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
不饱和酯类化合物在药物、涂料等领域应用广泛.下列反应是一种由烯烃制备不饱和酯的新方法:

(1)化合物I的分子式为 ,1mol化合物I能与 mol H2恰好完全反应生成饱和烃类化合物.
(2)化合物Ⅰ可由芳香族化合物Ⅱ或Ⅲ分别通过消去反应获得,但只有Ⅱ能与Na反应产生H2,Ⅱ的结构简式为 、 ;由Ⅲ生成Ⅰ的反应条件为 .
(3)聚合物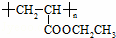 可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com