
【题目】Ⅰ、用如图仪器组装成一套简易量热计测定室温下中和反应的反应热。

(1)碎泡沫塑料的作用是__________;图中仪器a的名称是____________;
(2)中和反应的实质是_______________(用离子方程式表示)。
Ⅱ、.某研究性学习小组的同学对Zn、Cu、稀硫酸组成的原电池进行了探究,其中甲同学利用下图I装置进行探究,乙同学经过查阅资料后设计了图II装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
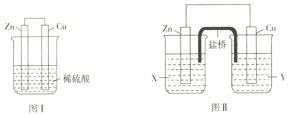
(3)实验表明,图I中两个电极上均有气泡产生,锌电极上有气泡产生,说明反应中有一部分化学能转化为_____能;铜电极上有气泡产生,说明反应中有一部分化学能转化为____能。
(4)图II中的X、Y是ZnSO4溶液及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X是_________,正极上的电极反应式为__________。
(5)当图I装置的溶液质量增加63g时,生成的氢气共有______L(标准状况;当图II中锌电极质量减少65g时,电路中转移的电子数为______NA。
Ⅲ、在一定条件下甲烷也可用于燃料电池。下图是甲烷燃料电池的原理示意图:
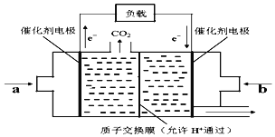
(6)若正极的反应式为O2+4e-+4H+=2H2O,则负极反应式为___________________;
【答案】减少实验过程中热量的损失 环形搅拌棒 H++ OH- = H2O 热 电 ZnSO4 2H++2e- = H2↑ 22.4 2 CH4-8e-+2H2O=CO2↑+8H+
【解析】
Ⅰ、(1)碎泡沫塑料的作用是减少实验过程中热量的损失;图中仪器a的名称是环形搅拌棒;
答案为:减少实验过程中热量的损失;环形搅拌棒;
(2)中和反应的实质是H++ OH- = H2O,
答案为:H++ OH- = H2O;
Ⅱ、 (3)图I中两个电极上均有气泡产生,锌电极上有气泡产生,锌与稀硫酸反应,该反应为放热反应,说明反应中有一部分化学能转化为热能;锌失去的电子经过导线转移到铜片表面,铜电极上有气泡产生,说明反应中有一部分化学能转化为电能。
答案为:热;电;
(4)锌失去的电子经过导线转移到铜片表面,溶液中的氢离子在铜片得到电子,放出氢气,则锌浸在ZnSO4溶液中,铜浸在稀硫酸中;铜片上的电极反应式为2H++2e- = H2↑。
答案为:ZnSO4;2H++2e- = H2↑
(5)当图I装置的溶液质量增加63 g时,溶解的锌为65g,生成的氢气为2 g,在标准状况下氢气的体积为![]() ×22.4 L/mol =22.4L;当图II中锌电极质量减少65g (1 mol Zn )时,电路中转移2 mol电子,电子数为2NA。
×22.4 L/mol =22.4L;当图II中锌电极质量减少65g (1 mol Zn )时,电路中转移2 mol电子,电子数为2NA。
答案为:22.4;2;
Ⅲ、(6)甲烷燃料电池,通入氧气的一极为原电池的正极,发生还原反应,电极反应为:O2+4e-+4H+=2H2O;甲烷为原电池的负极,发生氧化反应,电极反应为:CH4-8e-+2H2O=CO2↑+8H+,
答案为:CH4-8e-+2H2O=CO2↑+8H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向2L恒容密闭容器中加入1molNO和1molO3,发生反应![]() 。在不同温度下,分别测定体系中NO2的百分含量
。在不同温度下,分别测定体系中NO2的百分含量![]() 随反应时间的变化如图。
随反应时间的变化如图。
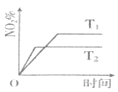
(1)T1______![]() ,
,![]() ______0,
______0,![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 理由是______;
理由是______;
(2)温度为![]() 时,反应2min时达到平衡状态。测得2min内,
时,反应2min时达到平衡状态。测得2min内,![]() ,则平衡时NO的转化率
,则平衡时NO的转化率![]() ______;
______;
(3)下列情况能表明该反应达到平衡状态的是______![]() 填代号
填代号![]() ;
;
A. NO消耗速率等于![]() 的生成速率 B.
的生成速率 B. ![]() :
:![]() :1
:1
C. 气体密度保持不变 D. 容器内气体颜色不再变化
(4)该反应达到平衡后,为加快反应速率同时提高NO的转化率,可采取的措施有______![]() 填标号
填标号![]()
A.使用高效催化剂 B.升高温度 C.再充人一定量的![]() D.缩小容器的体积
D.缩小容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________[c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。

①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要用18mol/L 浓硫酸配制100 mL 3.0mol/L 稀硫酸,请回答下列问题:
(1)所需浓硫酸的体积是________;量取浓硫酸所用的量筒的规格是_________(填选项代号)
A. 10mL B. 20mL C. 50mL D. 100mL
(2)实验操作步骤为:
A.把制得的溶液小心地转移至容量瓶中。
B.量取所需浓硫酸 ,在烧杯中用适量的蒸馏水将它稀释并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为___________________(填序号)。
(3)下列情况中,会使所配溶液浓度偏高的是___________(填序号)。
A.量取所需浓硫酸某同学观察液面时仰视
B.没有进行上述的操作步骤D
C.加蒸馏水时,不慎超过了刻度线
D.容量瓶使用前内壁沾有水珠
E.用少量蒸馏水洗涤量取浓硫酸后的量筒,洗涤的液体注入容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬酸铅![]() 用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
(1)![]() 中Cr的化合价为________________。
中Cr的化合价为________________。
(2)铬酸铅用于水彩和油彩的筑色颜料。遇到空气中的硫化物颜色会变黑:![]() 的平衡常数
的平衡常数![]() ________________。
________________。![]()
(3)铬渣![]() 铬主要以
铬主要以![]() 形式存在,同时含有
形式存在,同时含有![]() 、
、![]() 等杂质
等杂质![]() 是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
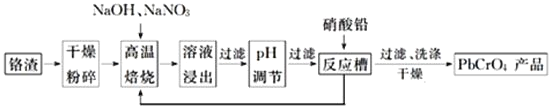
请回答下列问题:
![]() 铬渣高温焙烧前粉碎的目的是_____________________________。
铬渣高温焙烧前粉碎的目的是_____________________________。
![]() 高温焙烧得到的产物含有
高温焙烧得到的产物含有![]() 和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
![]() 高温焙烧时
高温焙烧时![]() 参加反应的化学方程式为________________________。
参加反应的化学方程式为________________________。
![]() 除去浸出液中的杂质最好加入________
除去浸出液中的杂质最好加入________![]() 填试剂名称
填试剂名称![]() 来调节pH。除去铝元素的离子方程式为___________________________________________。
来调节pH。除去铝元素的离子方程式为___________________________________________。
![]() 现通过以上流程处理
现通过以上流程处理![]() 的铬渣,得到
的铬渣,得到![]() 产品
产品![]() ,则铬渣中
,则铬渣中![]() 的质量分数是________
的质量分数是________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室用自来水制取蒸馏水的实验中,下列说法正确的是( )
A.蒸馏烧瓶中加满自来水并放入几粒沸石
B.冷凝水应该是下进上出,与蒸气的流向相反
C.开始蒸馏时,应该先加热,再通冷凝水
D.蒸馏完毕时,应该先停止通冷凝水再撤酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如图所示.下列说法正确的是( )
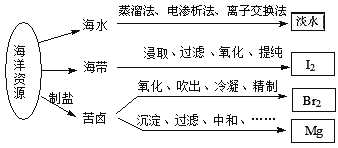
A. 从海水中获取淡水,历史最久的方法是离子交换法
B. 实验室中从海带中获得I2,需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等
C. 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
D. 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计“全氢电池”如图中甲池(其中a、b为多孔石墨电极),拟用该电池电解处理生活污水,达到絮凝净化的目的。其工作原理示意图:
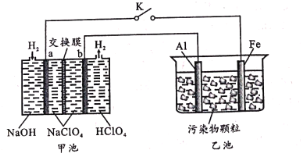
闭合K工作过程中,下列分析错误的是
A.甲池中a极反应为:H2-2e-+2OH-=2H2O
B.乙池中Fe电极区附近pH增大
C.一段时间后,乙池的两极间出现污染物颗粒沉降现象
D.如果Al电极上附着较多白色物质,甲池中Na+经过交换膜速率定会加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温25 ℃下,向一定量的0.1 mol·L-1的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-lgc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )
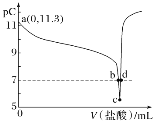
A.BOH为弱碱且Kb的数量级为10-5
B.b点溶液中:c(B+)=c(Cl-)
C.c点溶液中水的电离程度最大
D.c~d点间溶液中:c(BOH)+c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com