
实验室用下列仪器和药品制取干燥纯净的氯气。

1.按气流从左到右,装置正确的连接顺序为( )接( )接( )接( )接( )接( )接( )接( )(填各接口字母)
2.装置F的作用是 ,装置E的作用是 。
3.装置A和E中的反应化学方程式为
 A 。
A 。
E 。
4.某校化学兴趣小组称取8.7g二氧化锰与足量10mol/L的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1 = L
5.若该小组量取了10mol/L的浓盐酸40ml,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1 V2(填“>”、“<”或“=”),原因是
1.( a )( f )( h )( b )( c )( e )( d )( g )
2. 除掉氯气中混有的氯化氢 , 吸收多余的氯气 。
3. A MnO2+4HCl(浓)
A MnO2+4HCl(浓) 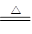 MnCl2+Cl2↑+2H2O E Cl2+2NaOH=NaCl+NaClO+H2O
。
MnCl2+Cl2↑+2H2O E Cl2+2NaOH=NaCl+NaClO+H2O
。
4.2.24 L
5.> 原因是随着反应进行,盐酸浓度减小,稀盐酸不与二氧化锰反应
【解析】实验室制取氯气的药品是浓盐酸和二氧化锰,由于浓盐酸具有挥发性,所以氯气中会混入氯化氢,所以在收集之前需要除去氯化氢,利用饱和食盐水来除氯化氢。因为需要高燥的氯气,因此还要通过浓硫酸进行干燥,然后才能收集。因为氯气的密度大于空气的,所以可通过向上排气法进行收集。氯气有毒,最好需要进行尾气处理,以防止污染空气。吸收多于的氯气可用氢氧化钠溶液。根据反应MnO2+4HCl(浓) 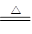 MnCl2+Cl2↑+2H2O可知,每消耗87g二氧化锰,就可以生成22.4L标准状况下的氯气,所以8.7g二氧化锰可生成2.24L氯气。40ml
10mol/L的浓盐酸的物质的量是0.4mol,根据反应式可知理论上应该生成0.1mol氯气。但由于在反应过程中盐酸的浓度逐渐降低,当降低到一定程度时,二氧化锰就不能再氧化盐酸,所以实际生成的氯气体积要小于0.1mol。
MnCl2+Cl2↑+2H2O可知,每消耗87g二氧化锰,就可以生成22.4L标准状况下的氯气,所以8.7g二氧化锰可生成2.24L氯气。40ml
10mol/L的浓盐酸的物质的量是0.4mol,根据反应式可知理论上应该生成0.1mol氯气。但由于在反应过程中盐酸的浓度逐渐降低,当降低到一定程度时,二氧化锰就不能再氧化盐酸,所以实际生成的氯气体积要小于0.1mol。


科目:高中化学 来源: 题型:阅读理解
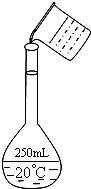 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com