
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+ , 模拟装置如图所示.下列说法正确的是( ) 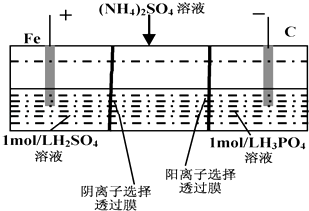
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为:4OH﹣﹣4e﹣=2H2O+O2↑
C.电解一段时间后,阴极室溶液中的酸性减弱
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
【答案】C
【解析】解:A.根据图片知,Fe与电源正极相连为阳极,阳极上Fe2+失电子发生氧化反应生成Fe3+ , 电极反应式为Fe2+﹣e﹣=Fe3+ , 所以溶液由浅绿色变为棕黄色,故A错误;
B.阴极上H+放电生成H2 , 电极反应式为2H2O+4e﹣═2OH﹣+H2↑,故B错误;
C.电解时,阴极上H+放电生成H2 , 溶液中c(H+)减小,酸性减弱,故C正确;
D.电解时,溶液中NH4+向阴极室移动,H+放电生成H2 , 溶液中OH﹣和NH4+结合生成电解质NH3 . H2O,所以阴极室中溶质为NH3 . H2O和(NH4)3PO4或NH4HPO4、(NH4)2HPO4 , 故D错误;
故选:C.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是( )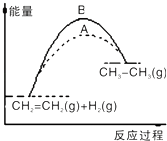
A.在一定条件下,某可逆反应的△H=+100kJmol﹣1 , 则该反应正反应活化能比逆反应活化能大100kJmol﹣1
B.图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0未使用和使用催化剂时,反应过程中的能量变化
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2 . 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
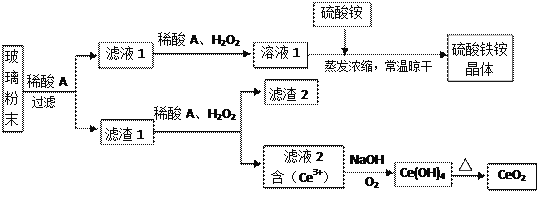
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是_________________________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为___________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式_____________________________________________________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理。相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。
该产品中Ce(OH)4的纯度为__________________。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:xA(g)+B(g)![]() C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为:c(A)x·c(B)=c(C)·c(D),若在温度不变的情况下,将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为:c(A)x·c(B)=c(C)·c(D),若在温度不变的情况下,将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
A. 40% B. 60% C. 24% D. 4%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表如示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
容器的体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
A. 甲中反应的平衡常数小于乙 B. 该温度下,该反应的平衡常数K为400
C. SO2的平衡转化率:α1>α2=α3 D. 容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答下列问题 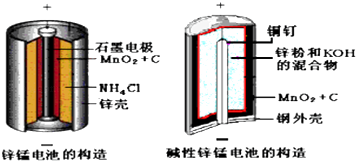
(1)酸性锌锰干电池的负极反应为 .
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式 .
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zng.(结果保留到小数点后两位,F=96500C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl![]() 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:
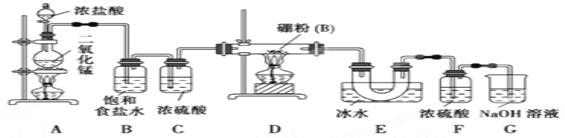
请回答下列问题:
(1)硼在周期表的位置是__________________________;
(2)E装置的作用是___________________________。如果拆去B装置,可能的后果是______________________。
(3)实验中可以用一个盛装_____________(填试剂名称)的干燥管代替F和G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:______________;
(5)为了顺利完成实验,正确的操作是________(填序号).
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓________(填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉,写出硼粉与滴加试剂的化学方程式___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com