
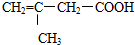 的结构,它不可能发生的反应是( )
的结构,它不可能发生的反应是( )| A. | 与银氨溶液反应析出银 | |
| B. | 使溴的四氯化碳溶液褪色 | |
| C. | 与乙醇在浓硫酸催化下发生酯化反应 | |
| D. | 与新制氢氧化铜反应 |
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能直接转变为电能的装置 | |
| B. | 原电池负极发生的电极反应是还原反应 | |
| C. | 原电池在工作时其正极不断产生电子并经外电路流向负极 | |
| D. | 原电池的电极只能由两种不同的金属构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
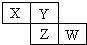 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )| A. | Y的气态氢化物比X的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Y的非金属性比Z的强 | |
| D. | X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
| A. | △H=+102kJ/mol | B. | △H=-102kJ/mol | C. | △H=+267kJ/mol | D. | △H=-267kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
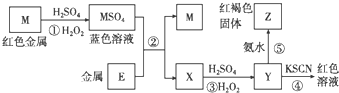
| A. | E2+的氧化性比M2+的氧化性强 | |
| B. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| C. | 反应④的离子方程式可表示为:E3++3SCN-?E(SCN)3↓ | |
| D. | 在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
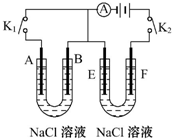 如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
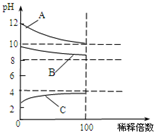 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com