
【题目】实验室用密度为1.25gmL﹣1 , 质量分数为36.5%的浓盐酸配制240mL 0.1molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为 .
(2)配制240mL 0.1molL﹣1的盐酸应量取浓盐酸体积mL,应选用容量瓶的规格mL.
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) .
A.用30mL水洗涤2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线处
(4)操作A中,将洗涤液都移入容量瓶,其目的是 .
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度线 .
②向容量瓶中转移溶液时不慎有溶液溅出 .
【答案】
(1)12.5mol/L
(2)2.0;5
(3)BCAFED;烧杯内壁;1﹣2cm
(4)避免溶质的量的减少,减小误差
(5)重新配置;重新配置
【解析】解:(1)浓盐酸的物质的量浓度C= ![]() =12.5mol/L;所以答案是:12.5mol/L;(2)要配置240ml的溶液,应选择250ml的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L=250mL×0.1molL﹣1 , 解得V=2.0ml,所以需要选择5ml的量筒;
=12.5mol/L;所以答案是:12.5mol/L;(2)要配置240ml的溶液,应选择250ml的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L=250mL×0.1molL﹣1 , 解得V=2.0ml,所以需要选择5ml的量筒;
所以答案是:2.0;5;(3)浓溶液配置稀溶液的一般操作步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,
烧杯壁上沾有溶质,为防止引起误差,必须洗涤烧杯内壁2﹣3次;
定容时,开始时直接加入蒸馏水,为防止加水过量,到离刻度线2﹣3cm时改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
所以答案是:BCAFED;烧杯内壁;2﹣3ml;(4)将洗涤液全部转移到容量瓶是因为避免溶质的量的减少,减小误差;
所以答案是:避免溶质的量的减少,减小误差;(5)①加蒸馏水时不慎超过了刻度线,实验失败,无法挽回,必须重新配置;
所以答案是:重新配置;②向容量瓶中转移溶液时不慎有溶液溅出,溶质的物质的量不准确,实验失败,必须重新配置;
所以答案是:重新配置.
【考点精析】掌握配制一定物质的量浓度的溶液是解答本题的根本,需要知道配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
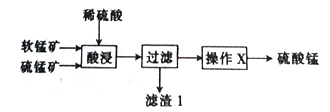
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于道尔顿近代原子论的观点有
A.原子还可由其他更小的微粒构成
B.原子中正电荷是均匀分布在整个原子中
C.原子在化学变化中保持其不可再分性
D.电子在原子核外空间做高速运动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C 又称“抗坏血酸”,在人体内有重要的功能.例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某燃煤发电厂处理废气的装置示意图.下列说法正确的是( ) 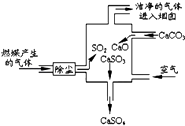
A.此过程中没有分解反应
B.整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2
C.使用此废气处理装置可减少CO2的排放
D.此过程中S元素的化合价未发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水热和有机溶剂等软化学方法,可合成出含有有机杂化锌、锗以及砷等金属的硒化物,且该硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为________________。元素锗与砷中,第一电离能较大的是_________(填元素符号,下同),基态原子核外未成对电子数较少的是_______________。
(2)H2SeO3分子中Se原子的杂化形式为____________,H2SeO4的酸性比H2SeO3强,原因是_________。
(3)气态SeO3分子的立体构型为____________,与SeO3互为等电子体的一种离子为_______(填离子符号)。
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为____________,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏伽德罗常数的数值,则晶胞参数ɑ为____________nm。
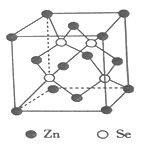
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法的目的与改变化学反应速率无关的是
A.牛奶在冰箱里保存
B.向玻璃中加入氧化铅
C.高炉炼铁前先将铁矿石粉碎
D.在糕点包装内放置小包除氧剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com