
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如右图所示的关系。下列说法正确的是( )

A.X、Y、Z都是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.如果X、Y都为非金属单质,则Z必为金属单质
D.如果X、Y都为金属单质,则Z必为非金属单质
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期教学质检化学试卷(解析版) 题型:选择题
三氯化磷分子的空间构型是三角锥形而不是平面正三角形。下列关于三氯化磷分子空间构型理由的叙述,正确的是:( )
A.PCl3分子中三个共价键的键长相等
B.PCl3分子中的P—Cl键属于极性共价键
C.PCl3分子中三个共价键的键长、键角均相等,
D.PCl3分子中P—Cl键的三个键的键长相等,且属于极性分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省等三校高一12月联考化学卷(解析版) 题型:选择题
2.3g 纯净金属钠一定条件下在干燥空气中被氧化后得到 3.5g 固体,由此判断其产物是 ( )
A.氧化钠 B.过氧化钠 C.氧化钠和过氧化钠 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省大庆市杜蒙县高二12月月考化学试卷(解析版) 题型:选择题
下列溶液中各微粒的浓度关系或说法正确的是( )
A.0.1 mol•L—1 pH为4的NaHB溶液中:c(HB—)>c(H2B)>c(B2-)
B.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是: ①>②>③>④
C.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中
c(Na+)>c(CN—),则a一定大于b
D.0.1mol·L-1的醋酸的pH=a,0.01mol·L-1的醋酸的pH=b,则a+1=b
查看答案和解析>>
科目:高中化学 来源:2017届福建省宁德市高三上学期单科质检模拟化学试卷(解析版) 题型:填空题
碳、氮广泛地分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s) + 6C(s) + 2N2(g) Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
(2)某研究小组现将三组CO(g) 与H2O(g) 的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g) + H2O(g)  CO2(g) + H2(g),得到下表数据:
CO2(g) + H2(g),得到下表数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | CO | H2 | |||
1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
2 | 900 | 1 | 2 | 0.5 | 0.5 | |
① 实验1中,前5min的反应速率v(CO2) = 。
② 下列能判断实验2已经达到平衡状态的是 (填序号)。
a.容器内CO、H2O、CO2、H2的浓度不再变化
b.容器内压强不再变化
c.混合气体的密度保持不变
d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③ 若实验2的容器是绝热的密闭容器,实验测得H2O(g) 的转化率ω(H2O)随时间变化的示意图如图1所示,b点v正 v逆(填“<”、“=”或 “>”),t3~t4时刻,H2O(g) 的转化率ω(H2O)降低的原因是 。
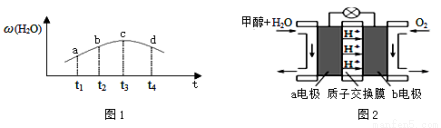
(3)利用CO与H2可直接合成甲醇,上图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol·L-1的CuSO4溶液,当电池消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2017届福建省宁德市高三上学期单科质检模拟化学试卷(解析版) 题型:选择题
从海带中提取碘的实验过程中,下列操作正确的是( )
A.  放出碘的苯溶液
放出碘的苯溶液
B.  分离碘并回收苯
分离碘并回收苯
C.  将海带灼烧
将海带灼烧
D. 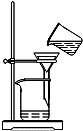 过滤含I-溶液
过滤含I-溶液
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江、吉林省两省六校高三上学期期中联考化学试卷(解析版) 题型:实验题
1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 | H+、NH4+ 、Al3+、K+ |
可能大量含有的阴离子 | C |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.

①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有 ;
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
n(Cl﹣) | 1.25mol | 1.5mol | 2mol |
n(Br﹣) | 1.5mol | 1.4mol | 0.9mol |
n(I﹣) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为 .
②原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江、吉林省两省六校高三上学期期中联考化学试卷(解析版) 题型:选择题
以NA表示阿伏加德罗常数的值, 下列说法正确的是( )
下列说法正确的是( )
A.0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA
B.0.1 mol/L氢氧化钠溶液中所含Na+数为0.1NA
C.1 mol Na2O2与水完全反应时转移电子数为2NA
D.46g NO 2和N2O4的混合气体中含有的原子个数为3NA
2和N2O4的混合气体中含有的原子个数为3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市宝坻区高二11月联考化学试卷(解析版) 题型:填空题
反应aA(s)+bB(g  cC(g)+dD(g)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示(填“增大”“减小”“吸”“放”“正”“逆”)
cC(g)+dD(g)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示(填“增大”“减小”“吸”“放”“正”“逆”)
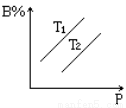
①当压强不变时,升高温度,B%变______,其反应为_______热反应。
②当温度不变,增大压强时,B%变_______,平衡向______方向移动,方程式中系数间关系是_____。
③当温度不变,增大压强时,若B%不变,则方程式中系数关系是____ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com