
分析 标准状况下224mLNO气体的物质的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,
由N元素守恒2n[Cu(NO3)2]+n(NO)=n(HNO3),可知n[Cu(NO3)2]=$\frac{1}{2}$[n(HNO3)-n(NO)]=$\frac{1}{2}$×(0.1L×0.6mol/L-0.01mol)=0.025mol,
由Cu元素守恒可得:2n(Cu2O)+n(CuO)+n(Cu)=n[Cu(NO3)2],由氧化还原反应得失电子守恒可知:2n(Cu)+2n(Cu2O)=3n(NO),以此来解答.
解答 解:硝酸具有强氧化性,硝酸与Cu、Cu2O和CuO组成的混合物恰好反应,生成Cu(NO3)2与NO,标准状况下224mLNO气体的物质的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,
由N元素守恒2n[Cu(NO3)2]+n(NO)=n(HNO3),可知n[Cu(NO3)2]=$\frac{1}{2}$[n(HNO3)-n(NO)]=$\frac{1}{2}$×(0.1L×0.6mol/L-0.01mol)=0.025mol,
设Cu的物质的量为x,
由Cu元素守恒可得:2×n(Cu2O)+n(CuO)+x=0.025mol,
由氧化还原反应得失电子守恒可知:x×2+2×n(Cu2O)=0.01×3,
解之得:n(CuO)=x-0.005mol>0,n(Cu2O)=0.015mol-x>0,
则0.005mol<x<0.015mol,
答:混合物中Cu的物质的量的取值范围为0.005mol<x<0.015mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握原子守恒、电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


科目:高中化学 来源: 题型:推断题
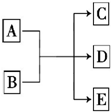 一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水晒盐属于化学变化 | B. | 电动车充电是化学能转变为电能 | ||
| C. | 不锈钢属于复合材料 | D. | 燃油以雾状喷出有利于完全燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钡可以从氯化钾溶液中置换出钾 | |
| B. | 钡可以从冷水中置换出氢而得到氢气 | |
| C. | 钡可以从氯化钠溶液中置换出钠 | |
| D. | 钡不能置换出金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.9g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA | |
| B. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目小于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ•mol-1 | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
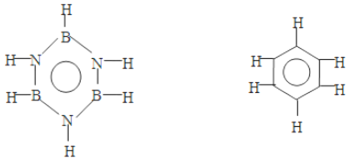
| A. | 2,3 | B. | 1,4 | C. | 2,4 | D. | 4,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,则转移电子2 mol | |
| C. | 氧化产物只有Fe3O4,还原产物只有S4O62- | |
| D. | 若有4 mol Fe2+被氧化,则被Fe2+还原的O2为1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com