
【题目】反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol(Lmin)﹣1
B.分别用B,C,D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol(Lmin)﹣1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】粗铜中一般含有锌、铁、银、金等杂质。在下图所示的装置中,甲池的总反应方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。接通电路一段时间后,纯Cu电极质量增加了3.2g。在此过程中,下列说法正确的是
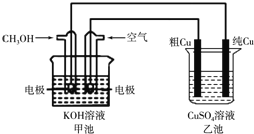
A. 乙池中CuSO4溶液的浓度不变
B. 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算)
C. 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置
D. 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O=CO32-+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧.现用下列方法测定该有机化合物的相对分子质量和分子结构. 方法一:用质谱法分析得知A的质谱图如图1: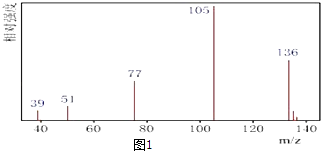
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1:2:2:3.如图2.
方法三:利用红外光谱仪测得A分子的红外光谱,如图3.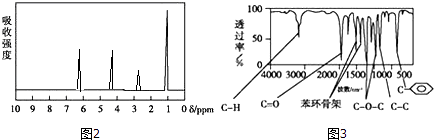
(1)分子中共有种化学环境不同的氢原子.
(2)A的分子式为 .
(3)该物质属于哪一类有机物 .
(4)A的分子中只含一个甲基的依据是(填序号). a.A的相对分子质量 b.A的分子式 c.A的核磁共振氢谱图 d.A分子的红外光谱图
(5)A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4在工业中有重要应用。用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
I.向软锰矿浆中通入SO2,锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2。
II.向浸出液中加MnO2,充分反应后,加入石灰乳,调溶液pH = 4.7。
III.再加入阳离子吸附剂,静置后过滤。
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体。
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程式是________。
(2)II中加入MnO2的主要目的是________;调溶液 pH=4.7,生成的沉淀主要含有________和少量CaSO4。
(3)III中加入阳离子吸附剂,主要除去的离子是________。
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2。
①电解MnSO4溶液的离子方程式是________。
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如下图所示,其中X是________,总反应的化学方程式是________。
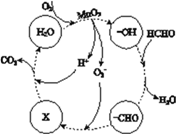
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL,回答下列问题:

(1)电源F是__________极;
(2)A池的第②极上的电极反应式_________
(3)通电前A池中原混合溶液Cu2+的浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2SO3·CuSO3·2H2O是一种深红色固体(以下用M表示)。某学习小组拟测定胆矾样品的纯度,并以其为原料制备M。
已知:①M不溶于水和乙醇,100℃时发生分解反应;
②M可由胆矾和SO2为原料制备,反应原理为3Cu2++6H2O+3SO2![]() Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
I.测定胆矾样品的纯度。
(1)取w g胆矾样品溶于蒸馏水配制成250mL溶液,从中取25.00mL于锥形瓶中,加入指示剂,用c mol·L-1EDTA(简写成Na4Y)标准溶液滴定至终点(滴定原理:Cu2++Y4-====CuY2-),测得消耗了V mL EDTA标准溶液。则该胆矾样品的纯度为____________%(用含c、V、w的代数式表示)。如果滴定管装液前没有用EDTA标准溶液润洗,测得的结果会_________ (填“偏高”“偏低”或“无影响”)。
Ⅱ.制备M。实验装置如下图所示:
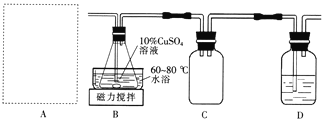
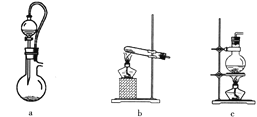
(2)实验室用70%硫酸与亚硫酸钠粉末在常温下制备SO2。上图A处的气体发生装置可从下图装置中选择,最合适的是________(填字母)。
(3)装置D中的试剂是____________。装置B中水浴加热的优点是____________________。
(4)实验完毕冷却至室温后,从锥形瓶中分离产品的操作包括:__________、水洗、乙醇洗、常温干燥,得产品Cu2SO3·CuSO3·2H2O。检验产品已水洗完全的操作是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大,其中C为金属元素,C的最外层电子数和A相等;C、D两元素原子的质子数之和为A、B两元素质子数之和的3倍。请回答:
(1)A为__________;B为__________;C为__________;D为__________;
(2)A、B、C、D的原子半径大小顺序为_________________________;
(3)A和B形成化合物A2B的电子式_________________________;
(4)用电子式表示C与D形成化合物C2D的过程:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关生物体细胞组成元素的叙述,错误的是( )
A. 在不同生物的体细胞内,组成它们的化学元素种类大体相同
B. 组成细胞的最基本元素是C
C. 在同一生物的不同体细胞内,各种化学元素的含量相同
D. 组成生物体细胞的化学元素,在无机自然界中都能找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为: Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)
下列有关该反应的推理不正确的是( )
A.该反应达到平衡时:c(Cu2+)=c(Mn2+)
B.CuS的溶解度比MnS的溶解度小
C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D.该反应平衡常数表达式:K= ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com