
| A. | 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g•cm-3 | |
| B. | 此溶液中KCl的质量分数为$\frac{74.5}{1.174×1000}$×100% | |
| C. | 密度大于1.174 g•cm-3的KCl溶液是过饱和溶液 | |
| D. | 25℃时,饱和KCl溶液的浓度大于4.0 mol•L-1 |
分析 A.将此溶液蒸发部分水,再恢复到20℃时,KCl溶解度不变,剩余溶液是饱和溶液;
B.根据c=$\frac{1000ρω}{M}$进行公式变形计算;
C.温度越高,KCl的溶解度越高,溶液密度越大,可能是不饱和溶液;
D.温度越高,KCl的溶解度越高,溶液浓度越大.
解答 解:A.若将饱和溶液蒸发,则有KCl晶体析出.再恢复到20℃时,其溶解度不变,溶液仍为饱和溶液,密度仍为1.174g•cm-3,故A错误;
B.20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0mol•L-1,溶液的质量分数为w=$\frac{4×75.5}{1000×1.174}$×100%≈25.38%,故B错误;
C.温度越高,KCl的溶解度越高,溶液密度越大,密度大于1.174 g•cm-3的KCl溶液可能是不饱和溶,故C错误;
D.KCl的溶解度随温度升高而增大,所以饱和溶液浓度会增大,20℃时是4mol/L,则25℃时大于4mol/L,故D正确,
故选D.
点评 本题考查物质的量浓度、溶解度、质量分数、溶液的性质等,难度不大,注意掌握温度与溶解度的关系,理解物质的量浓度与质量分数之间的关系.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
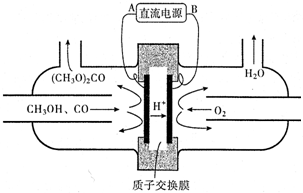
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 初步分离酒精和水的混合物(蒸发) | |
| B. | 除去FeCl2溶液中的少量铁粉(过滤) | |
| C. | 提纯NaCl和KNO3的混合物中的KNO3(萃取) | |
| D. | 分离溴的四氯化碳溶液中的溴(分液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
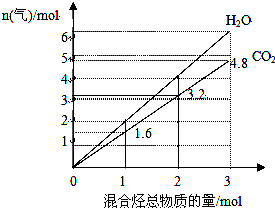 由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )
由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )| A. | 一定有乙烯 | B. | 一定有甲烷 | C. | 一定没有丙烷 | D. | 一定没有丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | 使温度都升高20℃后,两溶液的pH均不变 | |
| C. | 加水稀释2倍后,两溶液的pH均减小 | |
| D. | 加足量的锌充分反应后,盐酸中产生的氢气速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②⑥ | C. | ④⑤ | D. | ⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com