
��16�֣�����β���dz��п�������Ҫ��Ⱦ��֮һ������Ҫ�к��ɷ���CO���������NOx���ȡ�
��1��NOx������ԭ��֮һ����������������ʱ����N2��O2��Ӧ���������仯ֵ����ͼ��ʾ��

��N2(g)��O2(g) 2NO(g) ��H=���� ��
2NO(g) ��H=���� ��
��2������β����CO��NOx����Ч������Ϊ�����������Ҫ���⡣ij�о�С����ʵ������ij���ʹ�����CO��NO��ת�������о������NOת��ΪN2��ת�������¶ȡ�CO������ı仯�������ͼһ��
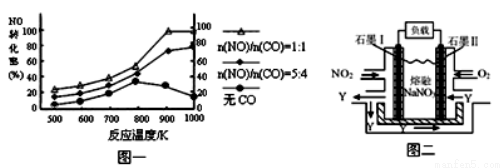
�� NO��CO���ʱ�����Ӧ�Ļ�ѧ����ʽΪ ��
�� 1000K��n(NO)/n(CO)=5:4ʱ��NO��ת����Ϊ75%����CO��ת����ԼΪ ��
�� ����n(NO)/n(CO)��ʵ�ʹ������Dz��ϱ仯�ģ���֤NOת���ʽϸߵĴ�ʩ�ǽ��¶ȴ�Լ������ K֮�䡣
��3������β����NOx����ͨ��ȼ�ϵ��ʵ��ת�����Ѿ������� NO2��O2������NaNO3�Ƴ���ȼ�ϵ�أ���ԭ����ͼ����
�� ͼ��ʯī��Ϊ��ص� ����
�� �ڸõ��ʹ�ù����У�ʯīI�缫�ϵIJ�����������Y����缫��ӦʽΪ ��
��4���״�Ҳ������ȼ�ϵ�ء���ҵ�ϲ��÷�ӦCO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H<0�ϳɼ״���
CH3OH(g)+H2O(g) ��H<0�ϳɼ״���
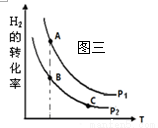
�� �ں����ܱշ�Ӧ���У�H2��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�
ϵ��ͼ����ʾ����A��B��C���㴦��Ӧƽ�ⳣ��(KA��KB��KC)��
��С��ϵΪ ��
�� ij�����£���6molCO2��8molH2����2L�ܱ������з���
��Ӧ���ﵽƽ�����c(CO2)=2.0mol��L-1������¶��·�Ӧ��ƽ
�ⳣ��ֵΪ ��
(16�֣�ÿ��2��)
��1�� +183 kJ��mol��1 ��2�֣�δд��λ��δд��+������1�֣�
��2����2CO+2NO��N2 +2CO2��2�֣�δ��ƽ��1�֣��� ��93%����NOת������ý��Ϊ93.75%��������NO�����ֽ��Ӱ�죬ʵ��ֵ�������ֵ�в�࣬���Իش�93.75%�������ֵ�����֣� ��800��900
��3���� NO2��NO3�� ��e�� ��N2O5
��4����KA��KB>KC ��1/2
��������
�����������1����ͼ��֪���������ӵĹ��ۼ�������Ҫ����945kJ���������������ӵĹ��ۼ�������Ҫ����498kJ����������2N��2O��ϳ�2��NO���ӷų�1260kJ�����������ԡ�H=945+498-1260=+183kJ/mol��
��2����NO��CO���ʱ�����ɵ����Ͷ�����̼����ѧ����ʽΪ2CO+2NO��N2 +2CO2��
��1000K��n(NO)/n(CO)=5:4ʱ��NO��ת����Ϊ75%����NO�����ʵ�����5mol����CO�����ʵ�����4mol,����NO�����ʵ�����5mol��75%=3.75mol��������CO �����ʵ�����3.75mol������CO��ת����Ϊ3.75mol/4mol��100%=93.75%��
����ͼһ��֪����n(NO)/n(CO)Ϊ��ֵ��800-900KʱNO��ת���ʽϸߣ�����900K��������CO����ʱ��NO��ת�����������ߣ�����COʱNO��ת����ȴ���½������������˵��¶���800-900K֮�䣻
��3������������ԭ��Ӧ������ͨ�������ļ��ǵ�ص�������ʯīIͨ����Ƕ����������壬����������Ӧ������������NԪ�صĻ��ϼ���+4�ۣ�NԪ�ػ��ϼ�����ֻ�����ߵ�+5�ۣ�����������Y��N2O5���缫��ӦʽΪNO2��NO3�� ��e�� ��N2O5
��4����A��B����¶���ͬ������ƽ�ⳣ����ͬ��C���¶ȸ���B���¶����ߣ�������Ӧ������ƽ�������С���������ߵĴ�С��ϵ��KA��KB>KC��
��6molCO2��8molH2����2L�ܱ������з���CO2(g)+3H2(g) CH3OH(g)+H2O(g) ƽ�����c(CO2)=2.0mol��L-1�������Ķ�����̼��Ũ����1mol/L,����������Ũ����3mol/L�����ɵļ״���ˮ������Ũ�ȶ���1mol/L,������ƽ��Ũ����mol/L,����K=c(CH3OH)c(H2O)/c(CO2)c(H2)3=1/2
CH3OH(g)+H2O(g) ƽ�����c(CO2)=2.0mol��L-1�������Ķ�����̼��Ũ����1mol/L,����������Ũ����3mol/L�����ɵļ״���ˮ������Ũ�ȶ���1mol/L,������ƽ��Ũ����mol/L,����K=c(CH3OH)c(H2O)/c(CO2)c(H2)3=1/2
���㣺���鷴Ӧ�ȵļ��㣬��ѧƽ�ⳣ�����жϼ����㣬�绯ѧ���۵�Ӧ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʲ���ʹ��ˮ��ɫ����ʹ���Ը��������ɫ����
A��C2H5OH ������B������ C���ױ������� D����ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫��Զ���и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʵı���ʽ��ȷ����
A����ϩ���ӵı���ģ��ʾ��ͼ�� B���Ҵ��Ľṹ��ʽ��CH3CH2OH
B���Ҵ��Ľṹ��ʽ��CH3CH2OH
C��2-��-2-��ϩ�ļ���ʽ 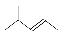 D��1��3-����ϩ�ķ���ʽ��C4H8
D��1��3-����ϩ�ķ���ʽ��C4H8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫��Զ���и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������������������Һ��Ӧ����
A��������B����֬C���Ҵ�D����ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫��Զ���и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������мȺ��й��ۼ��ֺ������Ӽ�����
A��HFB��NaClC��HClD��K2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫��ɽ��˳��������5�½�ѧ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A�������£�PH=9��̼������Һ����ˮ�������c(OH��)=1��10-9mol��L-1
B���¶���ͬʱ����������Һ��ǿ��ϡ��Һ�У�ˮ�����ӻ�����Kw��ͬ
C����pH��4�Ĵ�����Һϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ�����
D���к͵����pH��ͬ��H2SO4��HCl��Һ������NaOH�����ʵ���Ϊ2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㶫��ɽһ�С�������ѧ�ȸ�����У5��������ѧ�Ծ��������棩 ���ͣ������
��16�֣�������ҵ�г����ұ�����ķ����Ʊ�����ϩ��
��1����֪ij�¶��£�
��Ӧ�٣�CO2 ��g�� +H2 ��g����CO��g�� + H2O��g������H�� +41.2 kJ/mol
��Ӧ�ڣ�  ��g����
��g����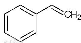 ��g��+H2��g���� ��H= +117.6 kJ/mol
��g��+H2��g���� ��H= +117.6 kJ/mol
�ڵĻ�ѧ��Ӧƽ�ⳣ���ֱ�ΪK1��K2��
��д��������̼�����ұ��Ʊ�����ϩ���Ȼ�ѧ��Ӧ����ʽ ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K�� ����K1��K2��ʾ����
��2�����ڷ�Ӧ�٣����º��������£����ܱ������м���2molCO2 ��2molH2������Ӧ�ﵽƽ�������˵����ȷ���� ��
A����Ϊ�÷�Ӧ�����ȷ�Ӧ�����������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С��
B������������1molCO2��1mol H2��ƽ��������Ӧ�����ƶ���
C��������ͨ��1mol CO2��ƽ��������Ӧ�����ƶ���CO2��ת��������
D��ѹ�������ƽ�ⲻ�ƶ�����Ӧ��Ͳ����Ũ�ȶ����䣻
��3���º��������£���Ӧ�ٴﵽƽ���t1ʱ��ͨ������CO2��������ͼ�л���t1֮������淴Ӧ���ߣ���������ע��

��4����֪ij�¶��£� Ag2SO4��M��312g/mol�����ܽ��Ϊ0.624g/100g H2O�����¶���Ksp��Ag2SO4���� ������λ��Ч���֣�
��5����ⷨ�Ʊ��������ƣ�Na2FeO4�����ܷ�ӦʽΪ��Fe+2H2O+2OH- �� FeO42-+3H2���������Һѡ��NaOH��Һ���õ������������� (д��ѧʽ) �������ĵ缫��ӦʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ��ʡ�����и�һ��ĩͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
���й��ڼ�����ӽṹ�������У���ȷ����( )
A�����������C��Hԭ�Ӽ������Ӽ� B��������ӵĿռ�ṹ��������
C������ĽṹʽΪCH4 D�����������4��̼�����ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ��ʡ�ڶ�ѧ����ĩ���Ը�һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������£����淴ӦN2 + 3H2 2NH3�ﵽ��ѧƽ��״̬������˵��һ����ȷ����(����)
2NH3�ﵽ��ѧƽ��״̬������˵��һ����ȷ����(����)
A��ÿ1 mol N��N���ѵ�ͬʱ��2 mol N��H����
B��N2��H2��NH3��Ũ��֮��Ϊ1:3:2
C��N2���ٵ����ʺ�NH3���ٵ�����֮��Ϊ1:2
D���������Ϊ��ʼ�����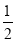
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com