
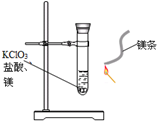
 如图,某同学将KClO3、浓盐酸、镁粉装进试管中,塞好胶塞,片刻后在管外点燃镁条,产生耀眼的白光,立即发现胶塞剧烈冲出.该同学的实验目的是
如图,某同学将KClO3、浓盐酸、镁粉装进试管中,塞好胶塞,片刻后在管外点燃镁条,产生耀眼的白光,立即发现胶塞剧烈冲出.该同学的实验目的是科目:高中化学 来源: 题型:阅读理解





| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.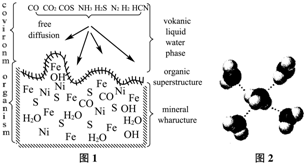
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省威海市高三上学期期末考试化学试卷(解析版) 题型:填空题
氯化铝融盐电解法是以氯化铝为原料,以碱金属或碱土金属氯化物(含少量MgCl2、KCl、CaCl2)为电解质进行电解制取铝的方法。
(1)氯化铝融盐电解法需要先制纯氧化铝。以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料通过以下途径提纯氧化铝:
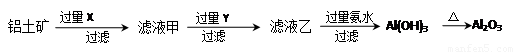
①依次写出X、Y的成分 , 。
②如图所示在实验室中进行过滤,操作中的两处错误分别是 ; 。
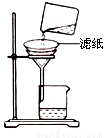
(2)制备无水氯化铝的反应为:2Al2O3+6Cl2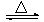 4AlCl3+3O2
4AlCl3+3O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是 。
④加入焦炭后的化学反应可表示为Al2O3+C+Cl2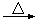 AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由
。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由
。
(3)现在工业上通常用电解熔融氧化铝方式制取铝,理论上生产1吨铝消耗的氧化铝的质量_________
(填“大于”、“小于”、“等于”)氯化铝质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化铝融盐电解法是以氯化铝为原料,以碱金属或碱土金属氯化物(含少量MgCl2、KCl、CaCl2)为电解质进行电解制取铝的方法。
(1)氯化铝融盐电解法需要先制纯氧化铝。以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料通过以下途径提纯氧化铝:

 |
①依次写出X、Y的成分 , 。
②如右图所示在实验室中进行过滤,
操作中的两处错误分别是 ;
。
(2)制备无水氯化铝的反应为:2Al2O3+6Cl2![]() 4AlCl3+3O2
4AlCl3+3O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是 。
④加入焦炭后的化学反应可表示为Al2O3+C+Cl2![]() AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
(3)现在工业上通常用电解熔融氧化铝方式制取铝,理论上生产1吨铝消耗的氧化铝的质量 (填“大于”、“小于”、“等于”)氯化铝质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com