
��12�֣�Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�pH��Fe2+Ũ�ȵķ�ˮ�м���H2O2���������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
��ʵ����ơ�����p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա�ʵ�顣
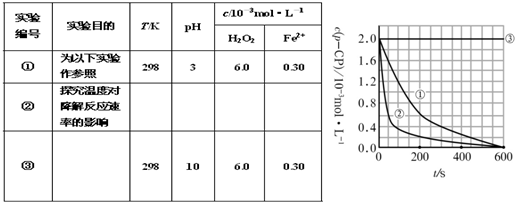
��1�����������ʵ����Ʊ������������п�ȱ�ط������в�Ҫ���ո�
|
ʵ���� |
ʵ��Ŀ�� |
T/K |
pH |
c/10-3mol��L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
�� |
Ϊ����ʵ�������� |
298 |
3 |
6.0 |
0.30 |
|
�� |
̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� |
|
|
|
|
|
�� |
|
298 |
10 |
6.0 |
0.30 |
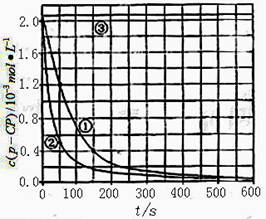
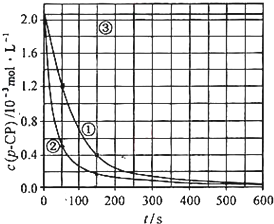
�����ݴ�����ʵ����p-CP��Ũ����ʱ��仯�Ĺ�ϵ������ͼ��
��2�����������ͼʵ������ߣ����㽵�ⷴӦ��50 -150�ڵķ�Ӧ���ʦ�(p-CP )=
����������ۡ�
��3��ʵ��٢ڱ����¶����ߣ����ⷴӦ���������¶ȹ���ʱ�������½��ⷴӦ���ʼ�С�����Fenton����ʹ���Լ�H2O2�ĽǶȷ���ԭ�� ��
��4��ʵ��۵ó��Ľ����ǣ�pH=10ʱ�� ��
��˼���뽻����
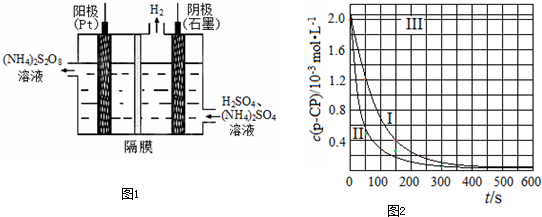
��5��ʵ��ʱ���ڲ�ͬʱ��ӷ�Ӧ����ȡ������ʹ��ȡ��Ʒ�еķ�Ӧ����ֹͣ������������ͼ����Ϣ������һ��Ѹ��ֹͣ��Ӧ�ķ����� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ���� | ʵ��Ŀ�� | T/K | pH | c/10-3mol��L-1 | |
| H2O | Fe2- | ||||
| ��1�� | Ϊ����ʵ�������� | 298 | 3 | 6.0 | 0.30 |
| ��2�� | ̽���¶ȶԽ��ⷴӦ�ٵ�Ӱ���� | ||||
| ��3�� | 298 | 10 | 6.0 | 0.30 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 Fe��SCN��2+�����鷴Ӧ�Ƿ���������ӣ���֪��һ���¶��¸÷�Ӧ�ﵽƽ��ʱc��Fe3+��=0.04mol?L-1��c��SCN-��=0.1mol?L-1��c[Fe��SCN��2+]=0.68mol?L-1������¶��¸÷�Ӧ��ƽ�ⳣ��K=
Fe��SCN��2+�����鷴Ӧ�Ƿ���������ӣ���֪��һ���¶��¸÷�Ӧ�ﵽƽ��ʱc��Fe3+��=0.04mol?L-1��c��SCN-��=0.1mol?L-1��c[Fe��SCN��2+]=0.68mol?L-1������¶��¸÷�Ӧ��ƽ�ⳣ��K=�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�� ��� |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| �� | 298 | 3 | 6.0 | 0.30 |
| �� | 313 | 3 | 6.0 | 0.30 |
| �� | 298 | 10 | 6.0 | 0.30 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
![]() Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�PH��
Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�PH��![]() Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
![]() [ʵ�����]����p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����顣
[ʵ�����]����p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����顣
![]() ��1�����������ʵ����Ʊ������в�Ҫ���ո�
��1�����������ʵ����Ʊ������в�Ҫ���ո�
| ʵ��
| ʵ��Ŀ�� | T/K | PH | c/10-3mol��L-1 | |
| H2O2 | Fe2+ | ||||
| �� | Ϊ����ʵ�����ο� | 298 | 3 | 6.0 | 0.30 |
| �� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | ||||
| �� |
| 298 | 10 | 6.0 | 0.30 |
![]() [���ݴ���]ʵ����p-CP��Ũ����ʱ��仯�Ĺ�ϵ������ͼ��
[���ݴ���]ʵ����p-CP��Ũ����ʱ��仯�Ĺ�ϵ������ͼ��
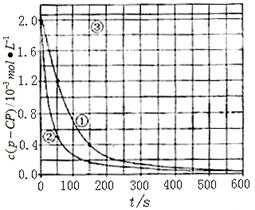
![]() ��2�����������ͼʵ������ߣ����㽵�ⷴӦ��50~150s�ڵķ�Ӧ���ʣ�
��2�����������ͼʵ������ߣ����㽵�ⷴӦ��50~150s�ڵķ�Ӧ���ʣ�
![]()
![]() ��p-CP��= mol��L-1��s-1
��p-CP��= mol��L-1��s-1
![]() [���������]
[���������]
![]() ��3��ʵ��١��ڱ����¶����ߣ����ⷴӦ���������¶ȹ���ʱ�������½��ⷴӦ���ʼ�С�����Fenton�������Լ�H2O2�ĽǶȷ���ԭ�� ��
��3��ʵ��١��ڱ����¶����ߣ����ⷴӦ���������¶ȹ���ʱ�������½��ⷴӦ���ʼ�С�����Fenton�������Լ�H2O2�ĽǶȷ���ԭ�� ��
![]() ��4��ʵ��۵ó��Ľ����ǣ�PH����10ʱ�� ��
��4��ʵ��۵ó��Ľ����ǣ�PH����10ʱ�� ��
![]() [˼���뽻��]
[˼���뽻��]
![]() ��5��ʵ��ʱ���ڲ�ͬʱ��ӷ�Ӧ����ȡ������ʹ��ȡ��Ʒ�еķ�Ӧ����ֹͣ������������ͼ�е���Ϣ������һ��Ѹ��ֹͣ��Ӧ�ķ�����
��5��ʵ��ʱ���ڲ�ͬʱ��ӷ�Ӧ����ȡ������ʹ��ȡ��Ʒ�еķ�Ӧ����ֹͣ������������ͼ�е���Ϣ������һ��Ѹ��ֹͣ��Ӧ�ķ����� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ̩���н������߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�PH��Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
��ʵ����ơ�����p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����顣
��1�����������ʵ����Ʊ������в�Ҫ���ո�
|
ʵ�� ��� |
ʵ��Ŀ�� |
T/K |
pH |
c/10-3mol��L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
�� |
Ϊ����ʵ�����ο� |
298 |
3 |
6.0 |
0.30 |
|
�� |
̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� |
|
|
|
|
|
�� |
|
298 |
10 |
6.0 |
0.30 |
�����ݴ�����ʵ����p-CP��Ũ����ʱ��仯�Ĺ�ϵ����ͼ��
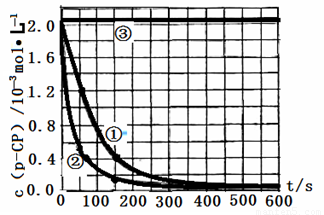
��2���������ͼʵ������ߣ����㽵�ⷴӦ��50~150s�ڵķ�Ӧ���ʣ�
�ԣ�p-CP��= mol��L-1��s-1
��3��ʵ��١��ڱ����¶����ߣ����ⷴӦ���������¶ȹ���ʱ�������½��ⷴӦ���ʼ�С�����Fenton�������Լ�H2O2�ĽǶȷ���ԭ��
��
��4��ʵ��۵ó��Ľ����ǣ�pH����10ʱ�� ��
��5��ʵ��ʱ���ڲ�ͬʱ��ӷ�Ӧ����ȡ������ʹ��ȡ��Ʒ�еķ�Ӧ����ֹͣ������������ͼ�е���Ϣ������һ��Ѹ��ֹͣ��Ӧ�ķ��� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com