
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | HCO3-的电离方程式:HCO3-+H2O═H2CO3+OH- | |
| D. | Cl2与H2O反应:Cl2+H2O═H++Cl-+HClO |
分析 A.二者反应生成硫酸钡和水;
B.高锰酸钾能够氧化双氧水生成氧气,本身被还原为二价锰离子;
C.碳酸氢根为弱酸的酸式根离子,部分电离产生碳酸根离子和氢离子,用可逆号;
D.氯气与水反应生成氯化氢和次氯酸.
解答 解:A.向Ba(OH)2溶液中滴加稀硫酸,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A正确;
B.酸性介质中KMnO4氧化H2O2,离子方程式:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故B正确;
C.HCO3-的电离方程式:HCO3-?CO32-+H+,故C错误;
D.Cl2与H2O反应,离子方程式:Cl2+H2O═H++Cl-+HClO,故D正确;
故选:C.
点评 本题考查了离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,注意弱电解质电离应用可逆号,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题

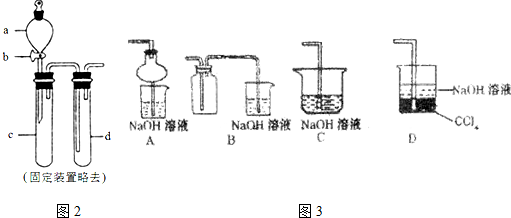
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

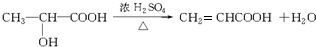 ;反应类型:消去反应;
;反应类型:消去反应; ;反应类型:酯化反应或取代反应.
;反应类型:酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
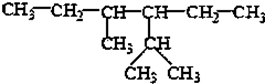 的系统命名为2,4-二甲基-3-乙基乙烷.
的系统命名为2,4-二甲基-3-乙基乙烷.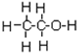 乙烯的电子式
乙烯的电子式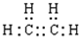
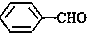
 <
<
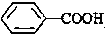 >CH3COOH(提示:类比酚和醇的酸性)
>CH3COOH(提示:类比酚和醇的酸性)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③④ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| B. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 1 molFe与足量的Cl2反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 美国化学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统电池.燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式.
美国化学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统电池.燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)<KSP(AgBr) | |
| B. | 将0.001mol•L-1 AgNO3溶液滴入0.001mol•L-1 KCl和0.001mol•L-1 K2CrO4混合溶液中,先产生Ag2CrO4沉淀 | |
| C. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| D. | 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂为K2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com