
| A. | 滤液A 可用于净水,其净水原理为Al3++3H2O═Al(OH)3+3H+ | |
| B. | 固体C→固体D 的操作过程中主要仪器是酒精灯、蒸发皿、玻璃棒 | |
| C. | 滤液C 中存在以下关系:c(Na+)=c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+) | |
| D. | 若在100 mL 滤液B 中加入1 mol•L-1HCl 200 mL,沉淀达到最大且质量为11.7 g,则滤液B 中c(Na+)大小2 mol•L |
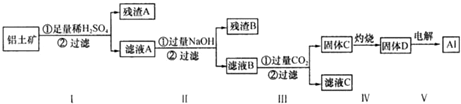
分析 SiO2和盐酸不反应,Fe2O3和NaOH溶液不反应而Al2O3能反应,向NaAlO2中通入过量的CO2可以生成Al(OH)3沉淀;
铝土矿加入足量稀硫酸可生成硫酸铝、硫酸铁,残渣A为二氧化硅,滤液A中含有硫酸铁、硫酸铝,加入过量NaOH溶液,得到残渣B为Fe(OH)3,滤液B为AlO2-,
步骤③通入二氧化碳,生成的沉淀为Al(OH)3,经过滤、洗涤、灼烧可得Al2O3,电解可得到铝,据此分析解答.
解答 解:SiO2和盐酸不反应,Fe2O3和NaOH溶液不反应而Al2O3能反应,向NaAlO2中通入过量的CO2可以生成Al(OH)3沉淀;
铝土矿加入足量稀硫酸可生成硫酸铝、硫酸铁,残渣A为二氧化硅,滤液A中含有硫酸铁、硫酸铝,加入过量NaOH溶液,得到残渣B为Fe(OH)3,滤液B为AlO2-,
步骤③通入二氧化碳,生成的沉淀为Al(OH)3,经过滤、洗涤、灼烧可得Al2O3,电解可得到铝,
A.通过以上分析知,滤液A 的主要成分为氯化铝,其净水原理为Al3++3H2O?Al(OH)3+3H+,由于水解程度小,不能用等号,故A错误;
B.在坩埚中灼烧Al(OH) 3得Al 2O3,故B错误;
C.滤液C 为NaHCO3、Na2SO4的混合溶液,根据电荷守恒有:c(Na+)=2 c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+),故C 错误;
D.滤液B 为NaOH、NaAlO2、Na2SO4的混合物,加入盐酸生成Al(OH) 311.7g,即n(NaAlO2)=0.15mol,NaOH、NaAlO2转化为NaCl,故c(Na +)>0.2mol•L-1,故D正确;
故选D.
点评 本题以框图题形式考查铝的化合物的性质,为高频考点,侧重于学生的分析能力和实验能力的考查,清楚流程图中发生的反应及各物质的成分及其性质是解本题关键,注意D选项的计算方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、Cl-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的KI-淀粉试纸鉴别Br2(g)和NO2(g) | |
| B. | 用新制Cu(OH)2悬浊液鉴别乙醛和丙醛 | |
| C. | 将CH4与CH2=CH2混合气体依次通过酸性KMnO4溶液、浓硫酸可得到纯净的CH4 | |
| D. | 用托盘天平、量筒、烧杯、玻璃捧配制10%的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 铵盐的质量/g | 2.15 | 4.30 | 6.45 |
| NH3的体积/mL | 672 | 1344 | 1344 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=2HClO+SO32- | |
| B. | 碳酸钙中滴入醋酸溶液:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O | |
| D. | 硫酸亚铁溶液中加过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| NH3 | C2H2 | CCl4 | CO2 |
| A. | A、 | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com