
分析 (1)碳酸钙与盐酸反应是二氧化碳,烧杯内减少的质量为生成的二氧化碳的质量;
(2)根据碳原子守恒计算碳酸钙物质的量,进而计算碳酸钙质量分数.
解答 解:(1)碳酸钙与盐酸反应是二氧化碳,烧杯内减少的质量为生成的二氧化碳的质量,则反应生成CO2的质量为12g+35g-42.6g=4.4g,故答案为:4.4;
(2)二氧化碳物质的量为$\frac{4.4g}{44g/mol}$=0.1mol,根据碳原子守恒:n(CaCO3)=n(CO2)=0.1mol,故样品中碳酸钙质量分数为$\frac{0.1mol×100g/mol}{12g}$×100%=83.3%,
答:石灰石样品中碳酸钙的质量分数为83.3%.
点评 本题考查化学方程式计算,比较基础,关键是利用质量守恒定律计算二氧化碳质量.


科目:高中化学 来源: 题型:解答题
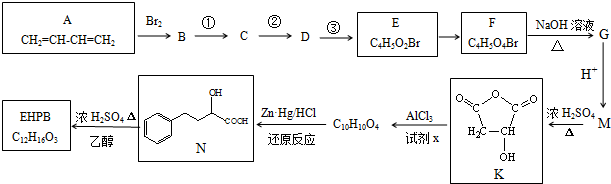
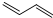 +Cl2$\stackrel{1,2-加成}{→}$
+Cl2$\stackrel{1,2-加成}{→}$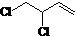 $\stackrel{1,4-加成}{→}$
$\stackrel{1,4-加成}{→}$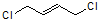
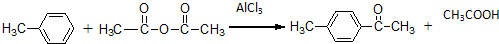
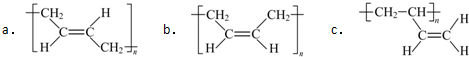
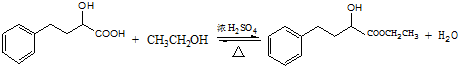 .
.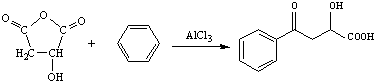 .
.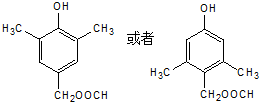 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖可通过酒化酶水解生成酒精 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 向植物油中加入酸性高锰酸钾紫色溶液,振荡后,酸性高锰酸钾溶液颜色褪去 | |
| D. | 淀粉溶液与稀硫酸溶液共热,再加入新制氢氧化铜悬浊液加热,无红色沉淀,则可证明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始温度T1/℃ | 终止温度T2/℃ | 温度差(T2-T1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
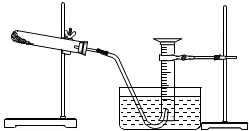 某同学完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制取氧气,测量生成氧气的体积.试回答:
某同学完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制取氧气,测量生成氧气的体积.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
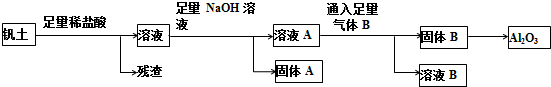
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com