
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(NO2) | 0.40 | a | 0.26 | c | d | e |
n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
(1)100s后降低反应混合物的温度,混合气体的颜色_________(填“变浅”、“变深”或“不变”)。
(2)20至40s内,v(NO2)=__________mol/(L·s),100℃时该反应的平衡常数K =_____________。
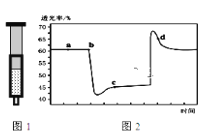
(3)将一定量的NO2充入密闭注射器中,图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是______________
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若密闭注射器为绝热容器,则T(b)>T(c)
D.d点时v(正)>v(逆)
(4)能说明反应2NO2(红棕色)![]() N2O4(无色)达平衡的是_________
N2O4(无色)达平衡的是_________
A. 体系的颜色不变 B. 恒容条件下,气体的密度不变
C. 2v正(NO2)=v逆(N2O4) D. 混合气体的平均摩尔质量不变
【答案】变浅 0.001 2.78 A AD
【解析】
(1)该反应△H<0,为放热反应,降温平衡右移;
(2)根据![]() 进行计算,根据K=
进行计算,根据K=![]() 进行计算;
进行计算;
(3)该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析;;
(4)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(1)二氧化氮为红棕色,该反应△H<0,为放热反应,降温平衡右移,二氧化氮浓度减小,混合气体颜色变浅,故答案为:变浅;
(2)20s时生成的n(N2O4)=0.05mol,根据方程式2NO2![]() N2O4可知消耗的二氧化氮为0.1mol,所以a=0.30mol,容器的体积为2L,所以20至40s内,v(NO2)=
N2O4可知消耗的二氧化氮为0.1mol,所以a=0.30mol,容器的体积为2L,所以20至40s内,v(NO2)= 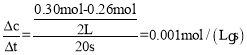 ;60s后N2O4的浓度不在发生变化,说明反应达到平衡,100℃时平衡时n(N2O4)=0.08mol,消耗二氧化氮为0.16mol,所以e=0.24mol,容器体积为2L,所以平衡时c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,K=
;60s后N2O4的浓度不在发生变化,说明反应达到平衡,100℃时平衡时n(N2O4)=0.08mol,消耗二氧化氮为0.16mol,所以e=0.24mol,容器体积为2L,所以平衡时c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,K=![]() =
=![]() ,故答案为:0.001;2.78;
,故答案为:0.001;2.78;
(3)A、b点之后,c点之前,透光率先减小,后小幅度上升,压缩注射器后,二氧化氮浓度增大,后由于压强增大平衡右移,二氧化氮浓度有所减小,故A正确;
B、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),故C错误;
D、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;
故答案为:A;
(4)A.平衡逆向移动颜色加深,正向移动颜色变浅,故颜色不变时说明反应达到平衡,故A正确;
B.恒容条件下气体总体积不变,总质量不变,故密度一直不变,故B错误;
C.反应达到平衡时v正(NO2)=v逆(NO2) ,v逆(NO2)= 2v逆(N2O4),所以2v正(NO2)=v逆(N2O4)不能说明反应达到平衡,故C错误;
D.混合气体的总质量不变,正向移动气体物质的量减少,平均摩尔质量增大,所以平均摩尔质量不变时能说明反应达到平衡,故D正确;
故答案为AD。


科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
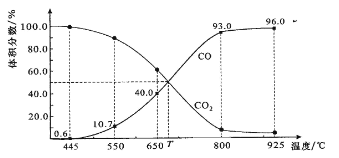
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g)![]() 2Z(g) ΔH=-akJ·mol-1,一定条件下,将1molX和3molY通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是
2Z(g) ΔH=-akJ·mol-1,一定条件下,将1molX和3molY通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是
A.10min内,Y的平均反应速率为0.03mol·L-1·s-1
B.第10min时,X的反应速率为0.01mol·L-1·min-1
C.10min内,消耗0.2molX,生成0.4molZ
D.10min内,X和Y反应放出的热量为akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。
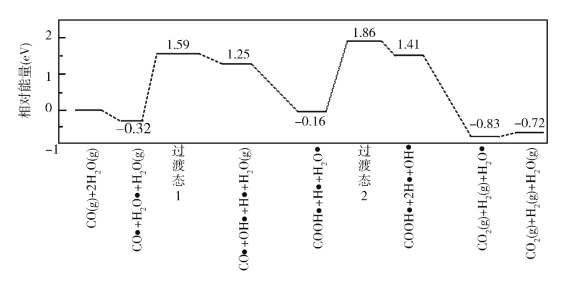
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
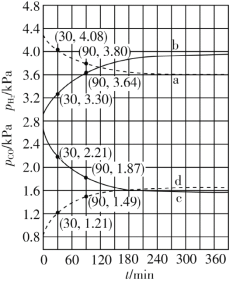
计算曲线a的反应在30~90 min内的平均速率![]() (a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
(a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是

A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去燃煤烟气中的有毒气体,一直是重要的科研课题。某科研小组设计如下装置模拟工业脱硫脱氮,探究SO2和NO同时氧化的吸收效果。模拟烟气由N2(90.02 %)、SO2(4.99%)、NO(4.99%)混合而成,各气体的流量分别由流量计控制,调节三路气体相应的流量比例,充分混合后进入A。(已知:FeSO4+NO![]() [Fe( NO)]SO4(棕色),下列说法不正确的是
[Fe( NO)]SO4(棕色),下列说法不正确的是
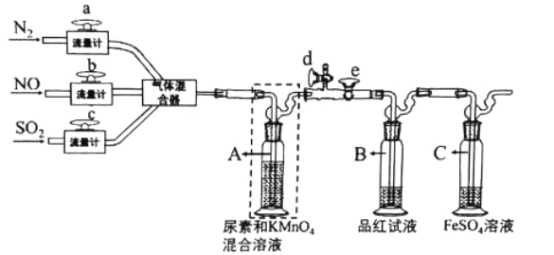
A. 反应开始前应该关闭d,打开e,通入一段时间的N2
B. 观察到装置A中有黑色固体生成,则A中反应为2H2O+3SO2+2MnO4—==3SO42—+2MnO2↓+4H+
C. 洗气瓶A的出气管口有两个玻璃球泡,目的是为了消除可能存在的未破裂的气泡
D. 实验中观察到B中红色褪去,C中变为浅棕色,说明KMnO4不能吸收NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)某温度,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(4)若在(3)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为__________,CO2的物质的量为__________。
a.等于1.0mol b.大于1.0mol c.大于0.5mol,小于1.0mol d.无法确定
(5)根据研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ·mol-1
4NH3(g)+3O2(g) ΔH=akJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的
②已知:N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
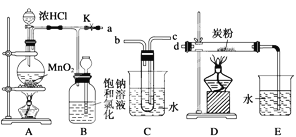
(1)C中试管中装有试剂水,要将C装置接入B和D之间,正确的接法是:a→___→___→d。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为____。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是___。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___。
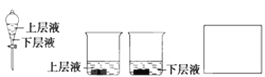
(4)用量筒量取20mLE中溶液,倒入分液漏斗中,然后再注入10mLCCl4,盖好玻璃塞(如图),振荡,静置于铁架台上,等分层后取上层液和下层液,再装入如图所示的烧杯中,能使有色布条褪色的是__(填“上层液”或“下层液”)。
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由___ ,并在方框中画出改进后的装置___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是
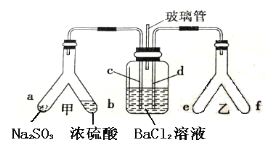
A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com