
| A. | 水中的钢闸门连接电源的负极 | B. | 金属护拦表面涂漆 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 地下钢管连接锌板 |
分析 在原电池中,负极被腐蚀,正极被保护,此方法称为牺牲阳极的阴极保护法;在电解池中,阴极被保护,此方法称为外加电源的阴极保护法,据此分析.
解答 解:A、水中的钢闸门连接电源的负极,即做电解质的阴极,此方法为外加电源的阴极保护法,故A错误;
B、金属护栏表现涂漆是用油漆隔绝空气和水,没有形成原电池或电解池,故B错误;
C、汽车底盘喷涂高分子膜,没有形成原电池或电解池,故C错误;
D.地下钢管连接锌板,其中钢管和锌板构成原电池,钢管做正极被保护,锌板做负极被腐蚀,即为牺牲阳极的阴极保护法,故D正确.
故选D.
点评 本题考查了金属腐蚀的防护,应注意的是金属防护的方法有喷漆、牺牲阳极的阴极保护法和外加电源的阴极保护法等,掌握防护的原理是关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
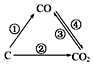 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/ (mol•L-1) | 0.44 | 0.6 | 0.6 |
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ/mol | |
| B. | 1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ | |
| C. | 在相同条件下,C(石墨,s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol | |
| D. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中NO2、NO和O2的物质的量之比为2:2:1 | |
| B. | 单位时间内生成2nmolNO同时生成2nmolNO2 | |
| C. | 单位时间内生成2nmolNO同时生成nmolO2 | |
| D. | 混合气体的颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
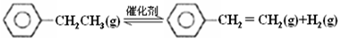
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
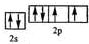 ,该元素的名称是氧;
,该元素的名称是氧;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com