
| A. | 检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化后,再检验 | |
| B. | 鉴别溶液中是否有SO42-,用盐酸酸化 | |
| C. | 为抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 |
分析 A.检验氯离子,利用硝酸银,但硫酸银也为沉淀;
B.加盐酸排除亚硫酸根离子、碳酸根离子的干扰;
C.硝酸可氧化亚铁离子;
D.高锰酸钾能氧化氯离子.
解答 解:A.检验氯离子,利用硝酸银,但硫酸银也为沉淀,则应加硝酸酸化,再检验,故A错误;
B.加盐酸排除亚硫酸根离子、碳酸根离子的干扰,然后用氯化钡鉴别溶液中是否有SO42-溶液,故B正确;
C.硝酸可氧化亚铁离子,则抑制亚铁离子水解,加盐酸或硫酸酸化,故C错误;
D.高锰酸钾能氧化氯离子,则应加稀硫酸酸化,故D错误;
故选B.
点评 本题考查化学实验方案的评价,把握离子检验、盐类水解及氧化还原反应等为解答的关键,侧重分析与应用能力的考查,注意酸化的目的,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
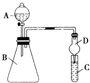 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
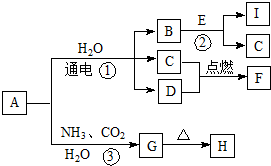 中学化学中的一些常见物质有下图转化关系(部分产物未给出).其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
中学化学中的一些常见物质有下图转化关系(部分产物未给出).其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.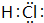 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 氯化铁溶液滴加到沸水中得到Fe(OH)3 胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | 铁溶于盐酸产生H2:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界里没有任何一种食物能同时满足人体对各种维生素的需要 | |
| B. | 用于2008年北京奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| D. | 葡萄糖、蔗糖、纤维素和脂肪在一定条件下都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g•mol-1 | B. | 24 g•mol-1 | C. | 56 g•mol-1 | D. | 188 g•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com