
【题目】甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol
反应②:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________V逆(填“>”、“=”或“<”)
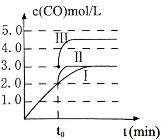
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________。
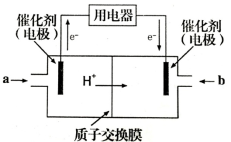
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________。
【答案】(1)+41.19 kJmol—1;(2)>;
(3)加入催化剂,2L;(4)CH3OH—6e-+H2O=CO2+6H+;
(5)2b×10-7/(a-2b)
【解析】
试题分析:(1)CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.77kJ/mol ①,
CH3OH(g) △H1=-90.77kJ/mol ①,
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2 ②,
CO(g)+H2O(g) △H2 ②,
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3=-49.58kJ/mol ③,
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol ③,
②=③-①得反应②的△H2=+41.19 kJ·mol-1;
(2)根据化学平衡常数的定义,K1=c(CH3OH)/c(CO)c2(H2)、K2=c(CO)c(H2O)/c(CO2)c(H2)、K3= c(CH3OH) c(H2O)/ c(CO2)c3(H2),则K3=K1×K2,500℃时K1、K2的值分别为2.5、1.0,则K3= K1×K2=2.5,该温度下反应③在某时刻,Q= c(CH3OH) c(H2O)/ c(CO2)c3(H2)=(0.3×0.15)/(0.83×0.1)=0.9<K3,反应正向进行,则此时V正>V逆;
(3)分析图像知t0时刻改变一个条件,曲线I变为曲线II,一氧化碳的平衡浓度没有变化而达平衡的时间缩短,改变的条件是加入催化剂;反应②为反应前后气体物质的量不变的反应,改变压强,平衡不移动,曲线I变为曲线III时,一氧化碳的浓度由0.3mol/L变为0.45mol/L,容器的体积由3L变为2L;
(4)此装置为原电池装置,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应,即甲醇被氧化为二氧化碳,结合碳元素的化合价变化确定失电子数目,根据原子守恒和电荷守恒配平,电极反应式为CH3OH—6e-+H2O=CO2+6H+;
(5)常温条件下,将a mol/L的CH3COOH与b mol/L Ba(OH)2溶液等体积混合,根据溶液呈现电中性:2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH—),又2c(Ba2+)=c(CH3COO-)= b mol/L,则溶液呈现中性,即c(H+)=c(OH—)=1×10-7mol/L,根据醋酸与氢氧化钡溶液反应的化学方程式确定混合液中c(CH3COOH)=(a-2b)/2mol/L,该混合溶液中醋酸的电离常数为c(CH3COO-)×c(H+)/ c(CH3COOH)= 2b×10-7/(a-2b)。


科目:高中化学 来源: 题型:
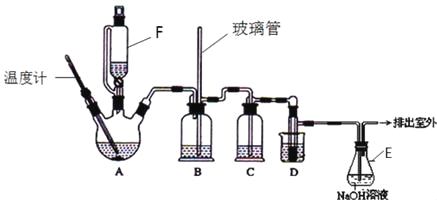
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。(夹持装置已略去)
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
填写下列空白:
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式: 。
D中发生反应的化学方程式为: 。
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是 。
(5)若产物中有少量副产物乙醚.可用________(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据各题要求填空
(1)聚乳酸纤维是一种新型可降解的高分子材料,主要以玉米、小麦、甜菜等含淀粉的农产品为原料,先水解为葡萄糖,经发酵生成乳酸后,再经缩聚和熔融纺丝制成。聚乳酸材料废弃后,它在土壤或海水中,先水解成乳酸,经微生物作用可分解为二氧化碳和水。请用化学方程式表示上述的整个过程的化学反应。
乳酸的结构为:![]()
①___________________________;
②___________________________;
③___________________________;
④___________________________;
⑤___________________________;(可以留空也可以自行补充)
(2)已知CH3Cl+2Na+CH3Cl→CH3—CH3+2NaCl,现有CH3CH2Br和CH3CHBrCH3的混合物与金属钠反应后,可能得到的烃的结构简式及名称是:
①___________________________;
②___________________________;
③___________________________;
④___________________________;(可以留空也可以自行补充)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性。物质:  ,具有光学活性,它发生下列反应后生成的有机物没有光学活性的是( )
,具有光学活性,它发生下列反应后生成的有机物没有光学活性的是( )
A.与NaOH溶液共热
B.与甲酸发生酯化反应
C.与银氨溶液发生银镜反应
D.在Ni催化下与H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素是最活泼的一族非金属元素,下列关于卤素(用X表示)的叙述正确的是
A. 单质均能与水反应生成HXO
B. 从上到下,HX的氧化性增强,对应水溶液酸性增强
C. 从上到下,卤素原子的电子层数依次增多,原子半径依次增大
D. 卤素均能形成最高价含氧酸,其分子通式为HXO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理的发展在化学的发展史上有重要的推动作用。
(1)下图为N2和O2生成NO时的能量变化情况。

则NO分解为N2和O2的反应是 (填“吸热”或“放热”)反应。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,一定条件下发生反应:
NO2(g)+ CO(g) ![]() CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
①该段时间内,用CO2表示的平均反应率为 。
②下列事实能说明此反应在该条件下已经达到化学平衡的是 (填序号)。
A.容器内气体总质量保持不变 B.NO2的物质的量浓度不再改变
C.NO2的消耗速率与CO2的消耗速率相等 D.容器内气体总物质的量保持不变
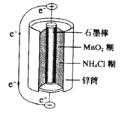
(3)锌锰干电池是最早使用的化学电池,其基本构造如下图所示。电路中每通过0.4mol电子,负极质量减少 g;工作时NH4+在正极放电产生两种气体,其中一种气体分子是含10电子的微粒,正极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在酒精灯加热条件下,Na2CO3和NaHCO3固体都能发生分解
(2)金属钠着火时,使用泡沫灭火器灭火
(3)在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA
(4)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是是铝与浓硫酸、浓硝酸不反应。
(5)由于铝的导电性能比铜强,所以常用铝制造电线、电缆
(6)Al2O3、MgO的熔点很高,可用作耐火材料。故常用氧化铝坩埚熔融NaOH固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 原电池是利用氧化还原反应将化学能转换为电能的装置
B. 由于生铁中含碳,所以比纯铁耐腐蚀
C. 在原电池中,电子从正极流向负极
D. 在原电池中,负极上发生还原反应,正极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有广泛用途。一种合成阿魏酸的反应可表示为:
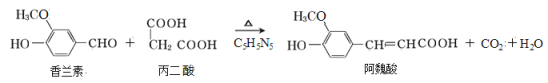
下列说法正确的是
A.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与Na2CO3、 NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com