
【题目】Li-Cu-空气燃料电池的原理示意如图,电池通入空气腐蚀铜电极而产生正极反应物Cu2O。下列有关说法正确的是
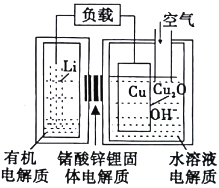
A. 电池工作时,正极上有金属锂析出
B. 电池工作时,负极区溶液中c(OH-)增大
C. 电池放电过程中的总反应为:2Cu+2Li++2OH-=2Li+Cu2O+H2O
D. 停止通入空气一段时间,电池将停止放电
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1 NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1 SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
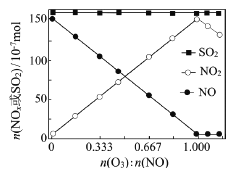
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是_________________
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是___________________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,溶液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:_________________________________________________________________________________
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=_____________________________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是__________________________________________________________________
(5)甲醇燃料电池在碱性溶液中的电极反应式。正极_________________________________;负极____________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、F、Se是六种重要的非金属元素。请根据所学的物质结构与性质的相关知识回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________种,基态硒原子的价层电子排布式为________,N元素第一电离能大于O元素第一电离能的原因为____________。
(2)某高效低毒的新型农药的结构简式为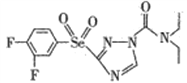 ,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
(3)SeO2、SeO2两种分子中,属于非极性分子的是________,SeO2的空间构型为________,与SeO3互为等电子体的分子和离子为________。(各写一种)
(4)氮化硼(BN)晶体有多种结构,六方相氮化硼(晶体结构如图1)是通常存在的稳定相,可作高温润滑剂,立方相氮化硼(晶体结构如图2)是超硬材料,有优异的耐磨性。
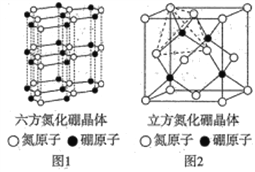
①下列关于这两种晶体的说法正确的是________ (填字母)。
a.两种晶体存在的作用力相同 b.立方氮化硼晶体可用于生产金属切割刀片
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②若图2中晶胞的边长为anm,密度为ρg·cm-3,则阿伏加德罗常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,将分液漏斗中溶液X加入圆底烧瓶中与Y反应,对试管B中现象描述不正确的是
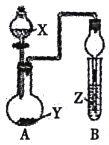
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 70%H2SO4 | Na2SO3溶液 | H2S溶液 | 产生浑浊 |
B | 浓氨水 | CaO | 酚酞试剂 | 溶液变红 |
C | 盐酸 | 大理石 | Na2SiO3溶液 | 出现白色沉淀 |
D | 浓盐酸 | MnO2 | NaOH溶液 | 黄绿色气体被吸收 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列对溶液中溶质组成成分判断正确的是( )
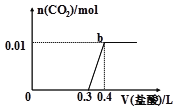
A. 原溶液中溶质为Na2CO3和NaHCO3
B. 原溶液中溶质为NaOH和Na2CO3
C. 原溶液中溶质为Na2CO3
D. 原溶液中溶质为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________,电子式为____________,结构式为____________,其立体构型为________。
(2)如图立方体中心的“●”表示甲烷分子中的碳原子,请在立方体的顶点用“●”表示出与之紧邻的4个氢原子的位置。______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.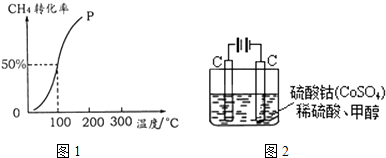
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 (g )△H=+206.0kJmol﹣1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=﹣129.0kJmol﹣1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0molCH4和2.0molH2O (g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1Mpa、温度为300℃条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填字母序号).
,其他条件不变,对平衡体系产生的影响是 (填字母序号).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: .
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2.通电后,Co2+放电变为Co3+ , 然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.①写出阳极电极反应式 .
②写出除去甲醇的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com