
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
科目:高中化学 来源: 题型:解答题
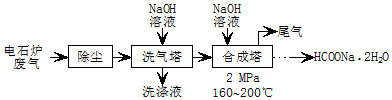
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
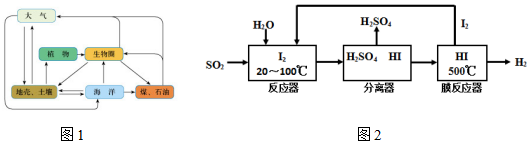

压强 温度℃ | 0.2Mpa | 1.0Mp | 10Mpa |
| 400 | 97.2% | 99.5% | 99.7% |
| 500 | 91.5% | 96.9% | 97.8% |
| 600 | 72.6% | 85.8% | 89.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全氮类物质属于绿色能源 | B. | 每个N5+中含有35个质子 | ||
| C. | 每个N5-中含有35个电子 | D. | N5+N5-结构中含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe (OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加人H2O2后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
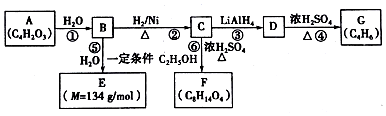
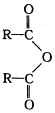 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)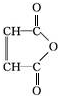 .
.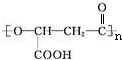 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 将少量溴水加入KI溶液中,充分反应后再加入CCl4,振荡,静置,下层液体呈紫色 | 氧化性:Br2>I2 |
| B | 常温下,打磨后的铝片放入HNO3中,无明显现象 | 常温下,铝不与浓HNO3反应 |
| C | 向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
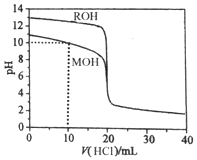
| A. | pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-) | |
| C. | 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-) | |
| D. | V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com