
分析 元素周期表中的递变规律:同周期元素的原子,从左到右,元素的金属性减弱,非金属性增强;氢化物稳定性增强;原子半径逐渐减小;最高价氧化物对应水化物的酸性逐渐增强;从下到上,元素的金属性减弱,非金属性增强;氢化物稳定性增强;原子半径逐渐减小;最高价氧化物对应水化物的酸性逐渐增强,以此解答该题.
解答 解:(1)与水反应最剧烈的非金属单质是位于最右上角的非金属单质,在原子序数1-18号元素中为F2,故答案为:F2;
(2)与水反应最剧烈的金属是位于左下角的金属,在原子序数1-18号元素中应该是Na,故答案为:Na;
(3)电子层越少,半径越小,所以原子半径最小的元素是H,故答案为:H;
(4)周期表中,从下到上,最高价氧化物对应水化物的酸性逐渐增强,同周期元素的原子,从左到右,最高价氧化物对应水化物的酸性增强,所以最高价氧化物对应水化物的酸性最强的酸是高氯酸,故答案为:HClO4;
(5)气态氢化物最稳定的物质位于周期表的最右上方,化学式是HF,故答案为:HF.
点评 本题考查学生元素周期表中的递变规律,为高频考点,侧重考查学生的分析能力,注意知识的归纳和整理是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1.000 g样品中一定含有NH4HCO3 0.316克 | |
| B. | 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4C1 | |
| C. | 原样品的含氮量为21% | |
| D. | 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨基酸为高分子化合物,种类较多,分子中都含有-COOH和-NH2 | |
| B. | 分子式为C6H12且碳碳双键在链端的烯烃共有6种异构体 | |
| C. | CH2=C(C2H5)2按系统命名法命名为2-乙基-1-丁烯,与(CH3)2C=C(CH3)2互为同系物 | |
| D. | 有机物  可发生加成、取代、氧化、酯化、水解反应 可发生加成、取代、氧化、酯化、水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
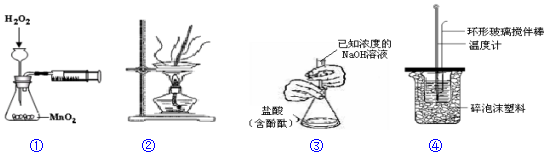
| A. | 装置①用于测定H2O2分解的反应速率 | |
| B. | 装置②用于蒸发FeCl3溶液制取FeC13晶体 | |
| C. | 装置③用于测定未知浓度的盐酸的浓度 | |
| D. | 装置④用于测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.65 kJ的热量 | |
| C. | 因为热化学方程式中的化学计量数只表示物质的量,所以化学计量数可以是分数 | |
| D. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 酸性:H2SO4>H3PO4>HClO4 | D. | 原子半径:K>Na>Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和氢氧化钠的能力:盐酸=醋酸 | |
| B. | 溶质的物质的量浓度:盐酸<醋酸 | |
| C. | 加水稀释10倍,溶液的pH:盐酸<醋酸 | |
| D. | 水电离出的c(H+):盐酸<醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂.化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂).
、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂.化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂).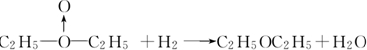 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com