
| c(NH4+) |
| c(OH-) |
| [NH4+] |
| [OH-] |
| 0.5mol/L×0.01L |
| 0.5L |
| 10-14 |
| 0.01 |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| A、将大小、形状相同的镁条和铝条与同浓度、同温度下的盐酸反应时,两者快慢相同 |
| B、盛有相同浓度的双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 |
| C、将浓硝酸分别放在的冷暗处和强光,发现强光下的浓硝酸分解得快 |
| D、将相同浓度Na2S2O2溶液与硫酸溶液混合,升高温度后溶液出现浑浊的时间变短,原因是反应物分子的能量增加,单位体积内活化分子百分数增大,有效碰撞次数增 |
查看答案和解析>>
科目:高中化学 来源: 题型:
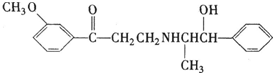
| A、可以在催化剂作用下和溴反应 |
| B、可以在碱性条件下发生水解反应 |
| C、能够使酸性高锰酸钾溶液褪色 |
| D、可以和浓硫酸与浓硝酸的混合液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

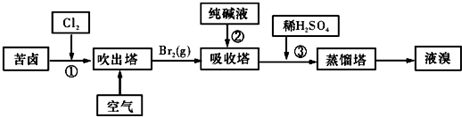
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)?c(A-) |
| c(HA) |
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?? H++CH3COO- | 1.75×10-5 |
| H2CO3 | H2CO3??H++HCO3- HCO3-??H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S??H++HS- HS-??H++S2-[来源:.Com] | K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 | H3PO4??H++H2PO4- H2PO4-?H++HPO42- HPO42-??H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
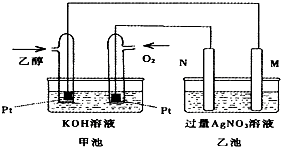 如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )
如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )| A、M电极的材料是石墨 |
| B、若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448ml |
| C、在此过程中,甲池中OH-向通乙醇的一极移动 |
| D、在此过程中,乙池溶液中电子从M电极向N电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C、“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D、电解MgCl2溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com