
|
下列条件下,反应 A+B | |
| [ ] | |
A. |
常温下 20 mL溶液含A、B各0.001 mol |
B. |
常温下 0.05 mol/L的A、B溶液各10 mL混合 |
C. |
标准状况下 0.1 mol/L的A、B溶液各20 mL混合 |
D. |
常温下 100 mL溶液含A、B各0.01 mol |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列条件下的反应,放出H2最快的是:( )
| ||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
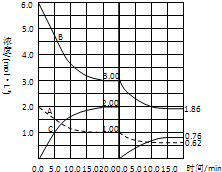 在恒容条件下发生反应A(g)+3B(g)
在恒容条件下发生反应A(g)+3B(g)| 催化剂 |
| A、第Ⅰ阶段用C表示的平衡前的反应速率v (C)=0.1 mol/(L?S) |
| B、第Ⅱ阶段中B的平衡转化率αⅡ(B)为0.019 |
| C、第Ⅰ阶段的平衡常数KⅠ与第Ⅱ阶段平衡常数KⅡ的大小关系是:KⅠ<KⅡ |
| D、由第一次平衡到第二次平衡,可能采取的措施是从反应体系中移出产物C |
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高二上学期第一次月考化学试卷(解析版) 题型:填空题
(10分)在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断
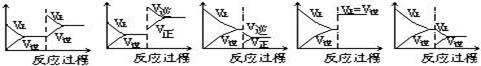
A. B. C. D. E.
(1)升温,达到新的平衡的是 (2)降压,达到新的平衡的是
(3)减少C的量,移向新平衡的是 (4)增加A的量,移向新平衡的是
(5)使用催化剂,达到平衡的是
查看答案和解析>>
科目:高中化学 来源:2010年沙河一中考前预测卷化学试题 题型:实验题
(14分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
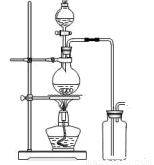
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3 H++HCO3-
Ka1 =4.45×10-7
H++HCO3-
Ka1 =4.45×10-7
HCO3-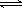 H++CO32-
Ka2=5.61×10-11
H++CO32-
Ka2=5.61×10-11
HClO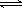 H++ClO-
Ka=2.95×10-8
H++ClO-
Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com