
NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应。实验室中可用氯气和氨气反应制取NCl3,反应方程式为4NH3+3C12===NCl3+3NH4Cl。某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右)。
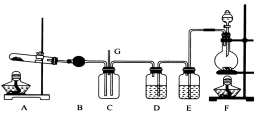
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式:___________________________。
(2)E中的试剂为__________________。
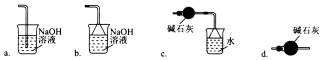
(3)导管G末端应连接的装置为下图中的___________(填选项字母)。
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,写出NCl3水解的化学方程式:_______________。
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为_____________________。
(6)NH4Al(SO4)2也可用于自来水的净化。
①NH4Al(SO4)2溶液中离子浓度由大到小的顺序为_________________。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,在此过程中水的电离程度_________(填“增大”“减小”或“不变”)。
③常温下,将a mol NH4Al(SO4)2:加入到b L c mol/L的氨水中,所得溶液呈中性,此时溶液中c(Al3+)≈0 mol/L,计算该温度下NH3·H2O的电离常数___________(用含字母的代数式表示,忽略溶液体积变化)。
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:2015-2016学年江西吉安一中高二下第二次段考化学试卷(解析版) 题型:填空题
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的△H__________0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)=0.003mol•L-1•s-1,则6S末CO2的物质的量浓度为__________;反应经一段时间后,达到平衡后CO的转化率为__________;
(3)判断该反应是否达到平衡的依据为_______(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O):c(CO)应不低于__________;
(5)已知CO可用于制备很多物质:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ•mol-1
2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-556.0kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
请写出S(g)与O2(g)反应生成SO2(g)热化学方程式_______________;
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三下第四次模拟理综化学试卷(解析版) 题型:简答题
【化学---选修2:化学与技术】水是生命之源,水的品质对于健康有着十分重要的意义。化学兴趣小组对某山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于 硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加 后加 ,原因是 。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂则水中的Ca2+、Mg2+与交换树脂的 起离子交换作用。若使用NaR作为阳离子交换树脂失效后可放入5%-8% 溶液中再生。
(4)海水淡化是获得淡水的重要来源。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、S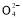 等离子,电极为惰性电极。请分析下列问题:
等离子,电极为惰性电极。请分析下列问题:

①阳离子交换膜是指 (填A或B)。
②写出通电后阳极区的电极反应式 。阴极区的现象是: 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三4月考试理综化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、Fe2+、Al3+、SO42-、Cl-五种离子,若向其中加入过量的Na2O2,微热并搅拌,再通入过量的HI气体,充分反应后,最后加入足量的硝酸酸化的硝酸钡溶液,则下列叙述不正确的是( )
A.反应后,溶液中NH4+、Fe2+、SO42-的物质的量减少,而Al3+、Cl-的物质的量不变
B.Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化
C.该实验中共有二种气体生成
D.Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三模拟押题理综化学试卷(解析版) 题型:推断题
[化学——选修5:有机化学基础]芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如图所示:
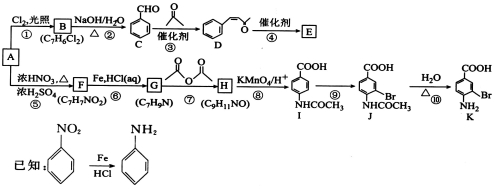
回答下列问题:
(1)A的名称是_____________。I含有官能团的名称是__________________。
(2)⑤的反应类型是________________,⑧的反应类型是________________。
(3)写出反应②的化学方程式:______________________________________。
(4)D分子中最多有_____________个原子共平面。E的结构简式为__________________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:__________________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备
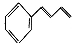 的合成路线补充完整。
的合成路线补充完整。
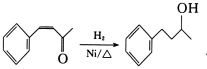 ________________________(无机试剂及溶剂任选)。
________________________(无机试剂及溶剂任选)。
合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三模拟押题理综化学试卷(解析版) 题型:选择题
X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素的一种原子不含中子,Y元素在大气中存在两种常见单质,Z与X处于同一主族,W原子最外层电子数是次外层电子数的0.875倍。下列叙述正确的是
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.最简单氢化物的沸点:Y>W
C.化合物Z2Y2与X2Y2中化学键完全相同
D.由Y、Z、W三种元素组成的化合物的水溶液一定显中性
查看答案和解析>>
科目:高中化学 来源:2016届福建师大附中高三下学期模拟考试理综化学试卷(解析版) 题型:简答题
氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因 。
(2)在恒温条件下,1 mol NO2和足量C发生反应:2NO2(g)+2C(s) N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
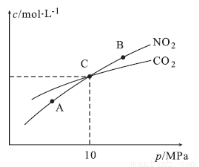
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp= (列出表达式并计算结果。Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)亚硝酸的电离平衡常数Ka=5.1×10-4(298K)。它的性质和硝酸很类似。
①已知298K 时,H2CO₃的Ka1=4.2×10-7 ;Ka2=5.61×10-11。向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是 。
②将10mL0.1mol/L的亚硝酸溶液加入到10mL0.1mol/L氨水(已知在25℃时,一水合氨的Ki= 1.8×10-5)中,最后所得溶液为________(填“酸性”、“碱性”或者“中性”)。
(4)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
②CaSO4(s)+ 4CO(g) CaS(s)+ 4CO2(g) △H = -189.2kJ•mol-1
CaS(s)+ 4CO2(g) △H = -189.2kJ•mol-1
反应CaO(s)+3CO(g)+SO2(g)  CaS(s)+3CO2(g) △H= kJ•mol-1;
CaS(s)+3CO2(g) △H= kJ•mol-1;
(5)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。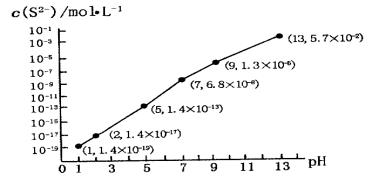
①pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
②某溶液含0.010 mol·L-1Fe2+和0.10 mol·L-1H2S,当溶液pH=______时,Fe2+开始沉淀。【已知:KSP(FeS)=1.4×10-19】
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一平行班下期中化学试卷(解析版) 题型:选择题
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )

A.Cu是原电池的负极
B.Al是原电池的负极
C.电子由Al沿导线流向铜
D.铝片上的电极反应式为:Al﹣3e﹣═AL3+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
已知:2X+Y 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )

A.T 1时,v正>v逆
B.正反应的△H<0
C.a、b两点的反应速率 v( a)=v( b)
D.T<T1时,ω增大的原因是平衡向正方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com