
A、 |
B、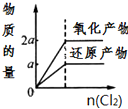 |
C、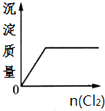 |
D、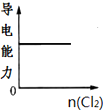 |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| A、1mol[Cu(NH3)2]2+中含有σ键的数目为12NA |
| B、0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA |
| C、分子数目为0.1NA的N2和NH3混合气体,原子间含有的公共电子数目为0.3NA |
| D、用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热,将湿润的红色石蕊试纸放在试管口观察颜色变化 |
| B、加水溶解,用红色石蕊试纸检验溶液酸碱性 |
| C、加入NaOH浓溶液,加热,将湿润的红色石蕊试纸放在试管口观察颜色变化 |
| D、加入强碱溶液,加热,再滴入酚酞试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
| A | K+、AlO2-、NO3- | 过量CO2 | CO2+2H2O+AlO2-═Al(OH) 3↓+HCO3- |
| B | Fe3+、I-、ClO- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ba2+、Na+、OH- | NaCO3溶液 | HCO3-+OH-═CO32-+H2O |
| D | NH4+、HCO3-、Cl- | NaOH溶液 | NH4++HCO3-+2OH-═CO32-+NH3.H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、0.1 mol?L-1HA溶液与0.05 mol?L-1NaOH溶液等体积混合后所得溶液中2c(H+)+c(HA)=c(A-)+c(OH-) |
| B、浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
| C、0.1 mol?L-1HA溶液与0.05 mol?L-1NaOH溶液等体积混合后所得溶液中c(A-)+c(HA)=c(Na+) |
| D、该溶液中由水电离出的c(H+)=1×10-11mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
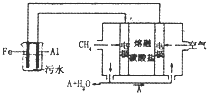 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间通过电解生成Fe(OH)3沉淀,Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,阴极产生的气泡把把污水中悬浮物带到水面而形成浮液层,刮去(或撇掉)浮渣层即起到了浮选净化作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间通过电解生成Fe(OH)3沉淀,Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,阴极产生的气泡把把污水中悬浮物带到水面而形成浮液层,刮去(或撇掉)浮渣层即起到了浮选净化作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com