
| A、CO32-、Na+、K+、OH- |
| B、Ba2+、CO32-、NO3-、SO42- |
| C、K+、Cu2+、Cl-、SO42- |
| D、Fe2+、NO3-、Cl-、SO42- |


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
| A、乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B、蔗糖和麦芽糖的水解产物都是葡萄糖 |
| C、石油经过分馏得到的各种产物是不同温度范围内的混合物 |
| D、苯和苯乙烯的最简式相同,是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①?? |
| B、只有①②?? |
| C、只有①②③?? |
| D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金的熔点一般比组分金属高 |
| B、合金中只含金属元素 |
| C、合金的机械性能一般比组分金属好 |
| D、合金不容易发生电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
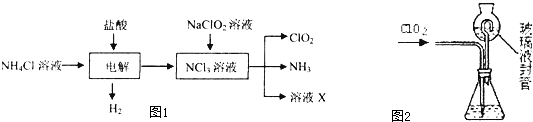
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉溶液中加入淀粉酶,再加入银氨溶液,出现银镜,说明淀粉已经全部水解 |
| B、除去苯中混有的苯酚,加浓溴水,然后过滤 |
| C、向澄清的苯酚钠溶液中通入CO2,可以看到澄清的溶液变浑浊 |
| D、可用水鉴别苯、四氯化碳、乙醇三种无色液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定是一种物质被氧化,另一种物质被还原 |
| B、物质在变化中失去电子,此物质是氧化剂 |
| C、发生电子转移的反应一定是氧化还原反应 |
| D、发生化合价升降的反应不一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com