
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。
I.请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为________。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为_________(填化学式);
(3)元素①、③形成的18电子化合物的电子式为______;
(4)元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式);
(5)元素⑤、⑧的最高价氧化物对应的水化物的水溶液反应的离子方程式为_________。
II.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(6)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是__(填物质化学式)。若电解液体积为2L(
(7)甲醛(HCHO)燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为________;
②该电池工作时,电子的流向为___________(填“从左到右”或“从右到左”);
③右侧电极的电极反应方程式为___________。
【答案】第二周期VIA H2O>NH3 ![]() Mg(OH)2 H+ + Al(OH)3 == Al3+ + 3H2O PbO2 3.5 甲醛 从左到右 O2 +4e- +4H+=2H2O
Mg(OH)2 H+ + Al(OH)3 == Al3+ + 3H2O PbO2 3.5 甲醛 从左到右 O2 +4e- +4H+=2H2O
【解析】
I.元素②和元素⑥最高正价均为+2价,应为第ⅡA族元素,②的半径比⑥大,所以②为Mg元素,⑥为Be元素;①的最低负价为-2价,且半径比Be小,则①应为O元素;③最高正价为+1价,且半径比O小,则③为H元素;④和⑦最高正价为+5价,最低负极为-3价,且④的半径大于⑦,则④为P元素,⑦为N元素;⑤的最高正价为+7价,最低负价为-1价,则⑤为Cl元素;⑧的最高正价为+3价,且半径大于P小于Mg,所以⑧为Al元素;
(7)根据氢离子流向可知左侧为原电池的负极,右侧为原电池的正极,甲醛燃料电池的总反应为2HCHO+O2=CO2↑+2H2O,左侧通入HCHO,右侧通入O2。
(1)①为O元素,原子序数为8,位于周期表中第二周期VIA族;
(2)非金属性O>N,非金属性越强,简单氢化物的稳定性越强,则稳定性:H2O>NH3;
(3)元素H、O形成的18电子化合物为H2O2,双氧水为共价化合物,其电子式为![]() ;
;
(4)金属性Mg>Al,则元素Mg、Al的最高价氧化物对应的水化物中,碱性较强的是Mg(OH)2;
(5)元素Cl的最高价氧化物对应的水化物为高氯酸,元素Al的最高价氧化物对应水化物为氢氧化铝,氢氧化铝与高氯酸反应的离子方程式为:3H++Al(OH)3=Al3++3H2O;
(6)铅蓄电池放电时为原电池,原电池正极得电子发生还原反应,根据总反应可知放电时PbO2被还原,所以PbO2为正极;根据总反应可知每转移2mol电子消耗2mol硫酸,所以转移3mol电子时,消耗3mol硫酸,浓度下降到![]() =3.5mol/L;
=3.5mol/L;
(7)①左侧为电池负极,甲醛燃料电池中甲醛被氧化,所以b口通入甲醛;
②原电池工作时电极由负极经外电路流向正极,即从左到右;
③右侧为原电池正极,氧气被氧化结合氢离子生成水,电极反应式为O2+4e-+4H+=2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有A、B两个完全相同的装置,某学生分别在它们的侧管中装入![]()
![]() 和
和![]()
![]() ,A、B中分别有10mL相同浓度的盐酸(不考虑盐酸的挥发),将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
,A、B中分别有10mL相同浓度的盐酸(不考虑盐酸的挥发),将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )

A.B装置的气球膨胀的体积大
B.最终两试管中NaCl的物质的量一定相同
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于![]()
D.若最终两气球体积相同,则盐酸的浓度一定大于或等于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】敌草胺是一种除草剂。它的合成路线如下:
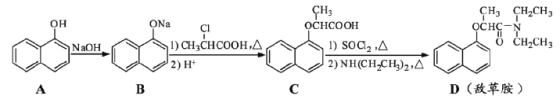
回答下列问题:
(1)在空气中久置,A由无色转变为棕色,其原因是______________________。
(2)C分子中不能与金属钠反应的官能团是______________________(填名称)。
(3)C转化为D的第一步反应有SO2生成,写出该反应的化学方程式______________。
(4)同时满足下列条件的C的同分异构体有______种。
①能与金属钠反应放出H2
②是萘的衍生物,且取代基都在同一个苯环上
③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氢
(5)若C不经提纯,产物敌草胺中将混有少量副产物E,E是一种由B和C生成的酯(变化过程中碳原子数未变),则E的分子式为___________________。
(6)已知:![]() ,若以苯酚和乙酸为原料制备
,若以苯酚和乙酸为原料制备![]() ,其合成路线为______________________。
,其合成路线为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A.酸式滴定管未用标准盐酸润洗
B.滴定过程中不慎有液体溅出
C.滴定前仰视读数,滴定后读数正确
D.碱式滴定管未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,写出N2和H2反应的热化学方程式:____________________.

(2)若已知下列数据:试根据表中及图中数据计算N-H的键能____________kJ·mol-1.
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1___________,E2 _________ (填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如4NH3(g)+3O2(g)=2N2(g)+6H2O(g);ΔH1= a kJ·mol-1N2(g)+O2(g)=2NO(g);ΔH2=b kJ/mol若1mol NH3还原NO至N2,写出该反应的热化学方程式__________(ΔH用a、b表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定![]() 假设盐酸与NaOH溶液混合后体积变化忽略不计
假设盐酸与NaOH溶液混合后体积变化忽略不计![]() ,滴定过程中溶液的pH变化如图所示。下列叙述正确的是
,滴定过程中溶液的pH变化如图所示。下列叙述正确的是![]()

A.所用HCl的浓度是![]() ,NaOH溶液浓度为
,NaOH溶液浓度为![]()
B.在B点,溶液中离子浓度关系为:![]()
C.A.![]() 三点水的电离程度大小依次为:
三点水的电离程度大小依次为:![]()
D.滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法符合事实的是
A.强酸与强碱中和滴定时可以选用甲基橙或酚酞作指示剂;强碱与弱酸中和滴定时应该选用酚酞作指示剂
B.在5![]() 的
的![]() 溶液中加入3mL等浓度的NaCl溶液,有白色沉淀产生,再加入3mL等浓度的
溶液中加入3mL等浓度的NaCl溶液,有白色沉淀产生,再加入3mL等浓度的![]() 溶液,溶液中又有黑色沉淀生成,说明
溶液,溶液中又有黑色沉淀生成,说明![]()
C.物质的量浓度均为![]() 的弱酸HX及其盐NaX溶液等体积混合后:
的弱酸HX及其盐NaX溶液等体积混合后:![]()
![]()
D.已知![]() ,
,![]() 。在含
。在含![]() 、
、![]() 浓度相同的溶液中滴加
浓度相同的溶液中滴加![]() 溶液时,首先生成
溶液时,首先生成![]() 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的离子浓度关系式正确的是
A.pH =2的H2C2O4(二元弱酸)溶液与pH=12的NaOH溶液任意比例混合:c(Na+) + c(H+)= c(OH-) + c(![]() )
)
B.pH = a的氨水溶液中,c(NH3·H2O) = 10-a mol/L
C.新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com