
【题目】下表是稀硫酸与某金属反应的实验数据:

分析上述数据,回答下列问题:
(1) 实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规
律另一组实验是___________(填实验序号)。
(2) 在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有____(填序号)。
(3) 本实验中影响反应速率的其他因素还有_________,其实验序号是_____。
(4) 实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
_________________________________________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO + 2CO![]() 2CO2 + N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2 + N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1) 前3s的平均反应速率v(N2)=_____________。(答案保留2位小数)
(2) 计算4s时CO的转化率α = 。
(3) 下列措施能提高NO和CO转变成CO2和N2的反应速率的是( )
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4) 研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/ mol·L-1 | 催化剂的比表面积/m2·g-1 |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 124 | |||
Ⅲ | 350 | 124 |
①请在上表格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿司匹林可由水杨酸制得,它们的结构如图所示。有关说法正确的是

A.服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液
B.阿司匹林的分子式为C9H10O4
C.1 mol阿司匹林最多可消耗2 mol NaOH
D.水杨酸可以发生取代、加成、氧化、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)=2H2O(l);△H=-572kJ/mol
②2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol
③CH4(g)+2O2(g)=2H2O(l)+CO2(g);△H=-890kJ/mol
(1)已知H-H的键能436kJ/molO=O的键能496kJ/molH-O的键能463kJ/mol,根据上述数据计算①②哪一个反应可以通过键能直接计算得出 。并计算写出反应 H2O ( l ) = H2O ( g )的焓变△H= 。
(2)请根据题干计算CO2(g)+4H2( g ) =CH4( g ) +2H2O( g )的焓变△H= 。
(3)在①②③三个方程式中哪一个是燃烧热的热化学方程式 。(填反应方程式的序号)标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为263.8kJ,试求混合气体中甲烷和氢气体积比 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现设计如下路线合成有机物E(C6H8O4),(其中A的相对分子质量是56,B的相对分子质量是125)。

(1)烃A的分子式是,D的结构简式为______________;
(2)③的反应类型是____________反应;
(3)已知E为顺式结构,则其结构简式是____________;
(4)下列说法正确的是____________(填序号)
a.反应①属于加成反应
b.B与二氯甲烷互为同系物
c.C存在立体异构体
d.D能使溴水褪色
(5)若C转化为D经过如下4步反应完成:![]() 。
。
则④的化学方程式是____________,⑥所需的无机试剂及反应条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠可大量用于染料和有机合成工业。请回答下列问题:
(1)亚硝酸钠能氧化酸性条件下的Fe2+,同时产生一种活性气体,该气体在空气中迅速变色。写出反应的离子方程式 。
(2)实验室模拟用如图所示装置通过如下过程制备亚硝酸钠:


已知:(I)氧化过程中,控制反应液的温度在35~60℃条件下发生的主要反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
(II)氢氧化钠溶液吸收NO、NO2发生如下反应:
NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O
①A中反应温度不宜高于60℃,原因是 。
②不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH外还有两种阴离子,其中一种是NO2,NO2与另一种阴离子的物质的量之比为 。
③B装置用于制备NaNO2,盛装的试剂除NaOH外,还可以是 。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3(aq)
(3)测定产品纯度:
I.准确称量ag产品配成100 mL溶液;
II.从步骤I配制的溶液中移取20.00 mL加入锥形瓶中;
III.用c mol·L1酸性KMnO4溶液滴定至终点;
IV.重复以上操作3次,消耗KMnO4酸性溶液的平均体积为V mL。
①锥形瓶中发生反应的离子方程式为 。
②滴定至终点的现象为 。
③产品中NaNO2的纯度为 (写出计算表达式)。
④若滴定终点时俯视读数,则测得的产品中NaNO2的纯度 (填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
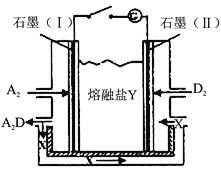
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500-600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。

回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 ,当生成1molCl2时,转移的电子数为 ,玻璃丝的作用是 ,装置B中加入的试剂是 。装置D中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 、 。
(3)若操作不当,制得的FeCl2会含有少量FeCl3杂质,下列说法中正确的是
A.检验FeCl3常用的试剂是KSCN溶液
B.可向固体混合物中加入适量Fe粉除去杂质
C.可向固体混合物中通入适量Cl2除去杂质
D.欲制得纯净的FeCl2,在实验操作中应先点燃A处的酒精灯,在点燃C处的酒精灯。
(4)现有一包FeCl2和FeCl3混合物,某化学兴趣小组为测定各成分的含量进行如下两个实验:
实验1:①称取一定质量的样品,将样品溶解;②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;③将沉淀过滤、洗涤、干燥得到白色固体28.7g。
实验2:①称取与实验1中相同质量的样品,溶解;②加入足量的NaOH溶液,③将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体6.4g。则样品中FeCl3的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个碳原子上如果连有3个氢原子,则这样的氢原子称为伯氢,如果只连有2个氢原子,则这样的氢称为仲氢,例如:-CH3中的氢原子为伯氢,-CH2-中的氢原子为仲氢。已知在烷烃中伯氢和仲氢被取代的活性因反应的条件不同而不同。在高温下伯氢与仲氢被取代的活性相等,则可以称之活性比为1︰1。请回答下列问题:
(1)已知丙烷在高温下与氯气发生取代反应,反应式如下:
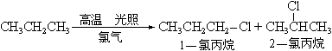
则在一氯代丙烷中1-氯丙烷在产物中的占有率为 ;
(2)常温下丙烷也能与氯气发生取代反应,反应式如下:

则在常温下伯氢和仲氢的相对活性比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com