
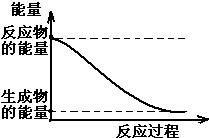
 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填分析 (1)当反应物的总能量高于生成物的总能量时,反应为放热反应;
(2)化学上把有热量放出的反应叫做放热反应,燃烧反应、中和反应等都是放热反应;把吸收热量的反应叫做吸热反应,一般分解反应、有碳参与的氧化还原反应、消石灰与氯化铵固体反应等是吸热反应.
解答 解:(1)从图可以看出,反应物的总能量大于生成物的总能量,而当反应物的总能量高于生成物的总能量时,反应为放热反应,故答案为:放热;大于;
(2)①发光放热的剧烈的氧化还原反应是燃烧,故燃烧一定是放热的,故①是放热的;
②酸碱中和反应一定是放热的,故②是放热反应;
③Ba(OH)2•8H2O与NH4Cl反应是典型的吸热反应,故③是吸热反应;
④二氧化碳通过炽热的碳是碳做还原剂的氧化还原反应,是吸热反应,故④是吸热反应;
⑤铝与四氧化铁在高温条件下的反应属于铝热反应,是剧烈的放热反应,故⑤是放热反应.
故属于放热反应的是:①②⑤;属于吸热反应的是:③④.
点评 此题是对放热吸热反应的考查,解题的关键是熟记教材提到的几个反应就可以.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| X Y | Z |
| ①NaOH溶液 Al(OH)3 | 稀硫酸 |
| ②KOH溶液 SiO2 | 氢氟酸 |
| ③O2 N2 | H2 |
| ④FeCl3溶液 Cu | 浓硝酸 |
| A. | ①③ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温时,在水电离出c(H+)=1.0×10-12mol•L-1的溶液中,K+、Na+、HCO3-、Cl-一定能大量共存 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA | |
| D. | 将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数大于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 反应产物的总焓大于反应物的总焓时,△H>0 | |
| C. | △H的大小与热化学方程式中的各物质的化学计量数无关 | |
| D. | 在化学反应中,发生物质变化的同时不一定发生能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| B. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 | |
| C. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 浓度均为0.1 mol/L的三种溶液:①Na2CO3溶液;②NaOH溶液;③CH3COONa溶液,溶液的pH:②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com