
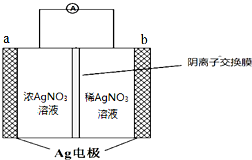
 ����һ���ڹ�ҵ���������й㷺��;�Ľ�����
����һ���ڹ�ҵ���������й㷺��;�Ľ��������� ��1��AgΪ�ؽ�������ʹ�����ʱ��ԣ����������H2S��Ӧ����Ag2S��
��2��ԭ���������������Ũ�Ȳ��γ�ԭ��أ������������Ũ��С�ķ����ƶ��������Ϊ�������Ҳ�Ϊ������
��3�����ݵ���ת����ȵ��ص���㣻
��4��AgCl���ڰ�ˮ������Ϸ�Ӧ�����ӷ���ʽΪAgCl+2NH3•H2O��aq��?[Ag��NH3��2]+ ��aq��+Cl-+2H2O��K=$\frac{c[Ag��N{H}_{3}��_{2}]^{+}��c��C{l}^{-}��}{{c}^{2}��N{H}_{3}•{H}_{2}O��}$=$\frac{c[Ag��N{H}_{3}��_{2}]^{+}��c��C{l}^{-}��}{{c}^{2}��N{H}_{3}•{H}_{2}O��}$��$\frac{c��A{g}^{+}��}{c��A{g}^{+}��}$���Դ˼���ƽ�ⳣ������Ӧ��������Σ�ˮ������ԣ�
��� �⣺��1���������Ϣ��֪Ag��ˮ��Һ�з���Ag?Ag++e-������Ag�ܽ��ͷŵ�Ag+ ���ؽ��������ӣ�ʹϸ�����ڵ����ʱ��ԣ��Ӷ�ɱ��������
Ag���������H2S��Ӧ����Ag2S������ʽΪ 2Ag+H2S=Ag2S+H2����
�ʴ�Ϊ��Ag?Ag++e-��Ag�ܽ��ͷŵ�Ag+ ���ؽ��������ӣ�ʹϸ�����ڵ����ʱ��ԣ��Ӷ�ɱ�������� 2Ag+H2S=Ag2S+H2����
��2��ԭ���������������Ũ�Ȳ��γ�ԭ��أ������������Ũ��С�ķ����ƶ��������Ϊ�������Ҳ�Ϊ������
a�缫�ķ�ӦΪAg++e-=Ag��NO3-�ӵ�� �����Һ�����Ҳ���Һ�ƶ�
�ʴ�Ϊ��Ag++e-=Ag�����ң�
��3������������������ֽ�ΪAg��NO2��O2������ʽΪ2AgNO3$\frac{\underline{\;����\;}}{\;}$2Ag+2NO2+O2����Ӧ������NO2��O2�����ʵ���֮��Ϊ2��1��
���������ͨ��ˮ����4NO2+O2+2H2O=4HNO3��������������ʣ��������
�ʴ�Ϊ��2��1��O2����������
��4��AgCl���ڰ�ˮ������Ϸ�Ӧ�����ӷ���ʽΪAgCl+2NH3•H2O��aq��?[Ag��NH3��2]+ ��aq��+Cl-+2H2O��
K=$\frac{c[Ag��N{H}_{3}��_{2}]^{+}��c��C{l}^{-}��}{{c}^{2}��N{H}_{3}•{H}_{2}O��}$=$\frac{c[Ag��N{H}_{3}��_{2}]^{+}��c��C{l}^{-}��}{{c}^{2}��N{H}_{3}•{H}_{2}O��}$��$\frac{c��A{g}^{+}��}{c��A{g}^{+}��}$=1.6��10-10��1.6��107=2.56��10-3��
���Ȼ������ڰ�ˮ�����Һ�еμ�ϡ���ᣬ���ٲ�����ɫ�Ȼ����������μ��������պó�����ȫ��ȡ�ϲ���Һ����pH�����ֳ����ԣ���Ҫԭ����笠�����ˮ������Ե��£�NH4++H2O?NH3•H2O+H+��
�ʴ�Ϊ��AgCl+2NH3•H2O��aq��?[Ag��NH3��2]+ ��aq��+Cl-+2H2O��K=2.56��10-3��NH4++H2O?NH3•H2O+H+��
���� ���⿼���Ϊ�ۺϣ��漰���ܵ���ʵ��ܽ�ƽ�⡢ԭ��ء�ƽ�ⳣ���ļ����֪ʶ��Ϊ�߿��������ͣ�������ѧ���ķ��������������Ŀ��飬ע����յ缫����ʽ����д�Լ�ƽ�ⳣ���ļ��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���ʹ��Na2CO3����Һ�У�2c��Na+��=c��CO32-��+c��HCO3-��+c��H2CO3�� | |
| B�� | 1mol/L�ģ�NH4��2SO4��Һ�У�c��NH4+����c��SO42-����c��H+����c��OH-�� | |
| C�� | 0.10mol/L��������Һ�У�c��Na+��+c��H+��=c��CH3COO-��+c��OH-�� | |
| D�� | �������pH=3������ʹ����к��������Ƶ����ʵ�����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״���һ����Ҫ�Ļ���ԭ�ϣ�
�״���һ����Ҫ�Ļ���ԭ�ϣ�| CO2%-CO%-H2% ����������� | 0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | ||||||||
| ��Ӧ�¶�/�� | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| ����CH3OH��̼ת���ʣ�%�� | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
��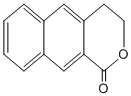 ��һ����Ҫ��ҩ��ϳ��м��壬������Ŀ������Ϣ��
��һ����Ҫ��ҩ��ϳ��м��壬������Ŀ������Ϣ��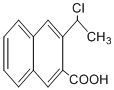 Ϊԭ���Ʊ��û�����ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
Ϊԭ���Ʊ��û�����ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�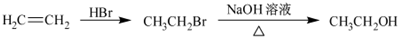
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʹ�����Ժ�ɫ����Һ�д������ڣ�Mg2+��Na+��Cl-��F- | |
| B�� | ��״���£�46gNO2��N2O4��������к���ԭ�Ӹ���Ϊ3NA | |
| C�� | 1L0.5mol•L-1 CuSO4��Һ�к���0.5NA��Cu2+ | |
| D�� | Ũ�Ⱦ�Ϊ0.1 mol/L�İ�ˮ�����ᡢ��ˮ�������c��H+���������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
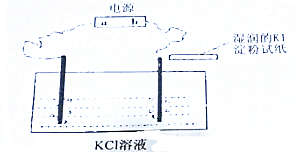
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C3H7Cl | B�� | C3H6Cl2 | C�� | C3H5Cl3 | D�� | C3HCl7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com