
解释下列事实:
(1)卤化锂在非极性溶剂中的溶解度顺序为:LiI>LiBr>LiCl>LiF。
(2)虽然锂的电离能比铯大,但![]() (Li+/Li)却比
(Li+/Li)却比![]() (Cs+/Cs)小。
(Cs+/Cs)小。
(3)虽然![]() (Li+/Li)<
(Li+/Li)<![]() (Na+/Na),但金属锂与水反应不如金属钠与水反应剧烈。
(Na+/Na),但金属锂与水反应不如金属钠与水反应剧烈。
(1)非极性或弱极性溶质的溶解性可以用相似相溶原理来说明,随着F-、Cl-、Br-、I- 的离子半径增大,极化率增大,LiF、LiCl、LiBr、LiI的共价键成分增强,分子的极性减弱,所以在非极性溶剂中的溶解度依次增大。
(2)![]() (M+/M)与△f
(M+/M)与△f![]() (M+,aq)有关,但从金属生成水合离子时,Li与Cs的△r
(M+,aq)有关,但从金属生成水合离子时,Li与Cs的△r![]() 相近,可忽略二者的差异,只考虑△f
相近,可忽略二者的差异,只考虑△f![]() 。虽然Li在升华及电离时吸收的能量都比Cs多,但Li+半径很小,水合热比Cs+大得多,足以抵消前两项吸热而有余。因此,△f
。虽然Li在升华及电离时吸收的能量都比Cs多,但Li+半径很小,水合热比Cs+大得多,足以抵消前两项吸热而有余。因此,△f![]() (Li+,aq)比△f
(Li+,aq)比△f![]() (Cs+,aq)更小,所以
(Cs+,aq)更小,所以![]() (Li+/Li)比
(Li+/Li)比![]() (Cs+/Cs)小。
(Cs+/Cs)小。
(3)虽然![]() (Li+/Li)<
(Li+/Li)<![]() (Na+/Na),但Li熔点高,升华焓大,不易活化,同时Li与H2O反应的产物LiOH溶解度较小,覆盖在金属表面减缓了反应。因此锂与水反应不如金属钠与水反应激烈。
(Na+/Na),但Li熔点高,升华焓大,不易活化,同时Li与H2O反应的产物LiOH溶解度较小,覆盖在金属表面减缓了反应。因此锂与水反应不如金属钠与水反应激烈。


科目:高中化学 来源: 题型:
 I.已知:
I.已知: ,如果要合成
,如果要合成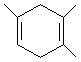 ,所用的原料可以是
,所用的原料可以是

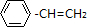
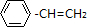


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
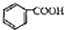 )和石灰的混合物得到苯,写出苯甲酸钠与碱石灰(其中的NaOH参与反应)共热生成苯的化学方程式
)和石灰的混合物得到苯,写出苯甲酸钠与碱石灰(其中的NaOH参与反应)共热生成苯的化学方程式 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)FeS不溶于水,但能溶于稀盐酸中:___________________________________________。
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中:________________________________________。
(3)分别用等体积的蒸馏水和0.010 mol·L-1硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量:_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com