
已知常温下,在溶液中发生如下反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O;②2A2++B2=2A3++2B-;③2B-+Z2=B2+2Z-由此推断下列说法错误的是( )。
A、反应Z2+2A2+=2A3++2Z-可以进行
B、Z元素在①反应中被氧化,在③反应中被还原
C、还原性由强到弱的顺序是Z-,B-,A2+,X2+
D、氧化性由强到弱的顺序是XO4-,Z2,B2,A3+
科目:高中化学 来源:2016届湖北省高一上学期期中考试化学试卷(解析版) 题型:选择题
同温同压下,质量忽略不计的两气球A和B,分别充入X气体和Y气体,且充气后两气球的体积相同.若相同条件下,A气球放在CO中静止不动,B气球放在O2中上浮.下列叙述或表示正确的是( )
A.X气体的相对分子质量比Y气体的相对分子质量大
B.X可能是N2,Y可能是CH4
C.X气体的密度小于Y气体的密度
D.充气后A气球质量比B气球质量大
查看答案和解析>>
科目:高中化学 来源:2016届海南省琼海市高一上学期段考化学试卷(解析版) 题型:填空题
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
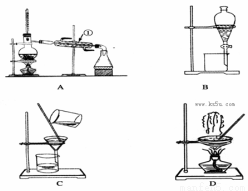
(1)从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是从 口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是 。
查看答案和解析>>
科目:高中化学 来源:2016届海南省琼海市高一上学期段考化学试卷(解析版) 题型:选择题
下列物质中所含分子物质的量最多的是( )
A.44 g CO2 B.1.5 mol H2
C.64 g SO2 D.3.01×1023个硫酸分子
查看答案和解析>>
科目:高中化学 来源:2016届海南省三亚市高一上学期期中考试化学试卷(A)(解析版) 题型:填空题
实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
① ,② ,③ ,④ ,⑤ ,⑥ 。
(2)所需仪器为:托盘天平、还需要那些实验仪器才能完成该实验,请写出: 。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响: ,原因是: 。
查看答案和解析>>
科目:高中化学 来源:2016届海南省三亚市高一上学期期中考试化学试卷(A)(解析版) 题型:选择题
下列反应的离子方程式,正确的是( )。
A、碳酸氢钠和烧碱溶液:HCO3-+OH-=CO32-+H2O
B、石灰水中通入过量的CO2: CO2+Ca2++2OH-=CaCO3↓+H2O
C、稀硫酸和氢氧化钡:Ba2++SO42-=BaSO4↓
D、氯化铁溶液和氨水:Fe3++3OH-=Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2016届海南省三亚市高一上学期期中考试化学试卷(A)(解析版) 题型:选择题
下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.氯化钠晶体、硫酸钡 B.铜、二氧化硫
C.硫酸、酒精 D.熔融的硝酸钾、硫酸钠溶液
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高一下学期期中考试化学试卷(解析版) 题型:选择题
在100 mL等物质的量的HBr和H2SO3的混合液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
A.0.0075 mol·L-1 B.0.008 mol·L-1
C.0.075 mol·L-1 D.0.08 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高一上学期期中考试化学试卷(解析版) 题型:填空题
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3+4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl+2 H2O
方法二:2 NaClO3+H2O2+H2SO4=2 ClO2↑+ O2↑+Na2SO4+2 H2O
(1)方法一的离子方程式为 ;
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L;在下面的化学式上标出电子转移的方向和数目
2 NaClO3+H2O2+H2SO4=2 ClO2↑+ O2↑+ Na2SO4+2 H2O
(3)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO—与ClO3—的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com