
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )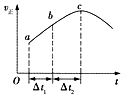
A.反应物的总能量低于生成物的总能量
B.△t1=△t2时,CO的转化率:a~b段小于bc段
C.反应在c点达到平衡状态
D.反应物浓度:a点小于b点
【答案】B
【解析】A.从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,A不符合题意;
B.着反应的进行,正反应速率越快,消耗的CO就越多,CO的转化率将逐渐增大,所以△t1=△t2时,CO的转化率:a~b段小于bc段,B符合题意;
C.a化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,C不符合题意;
D.随到b时正反应速率增加,反应物浓度随时间不断减小,所以反应物浓度:a点大于b点,D不符合题意;
故答案为:B.
A.影响速率的因素有多种,要从题目中确定C点前主要因素为温度;B,平衡前相同时间内速率越快,反应物的转化率越大;C.化学平衡状态的标志是各物质的浓度不再改变速率不再变化;D.平衡前反应物浓度随时间不断减小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是
A.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.氧化铜溶于稀硫酸:O2-+2H+=H2O
C.氢氧化钠溶液与过量碳酸氢钙溶液反应:OH-+HCO3-+Ca2+=CaCO3↓+H2O
D.硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列图象说法错误的是( )
A.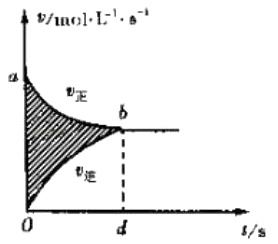
图阴影部分面积表示反应物浓度的净减少量M
B.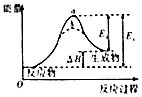
图虚线b表示反应加入催化剂后能量变化曲线
C.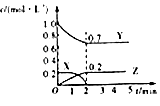
图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)2Z(g)
D.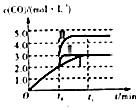
图对应于反应H2(g)+CO2(g)H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在影响社会经济发展和人民生活的各种要素中,淡水资源占有极为特殊的地位。下列可以用来进行海水淡化的方法是
A.萃取法B.过滤法C.蒸馏法D.分液法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )
A.前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(Lmin)
B.反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g)
C.若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g)
D.a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(结构简式为![]() )有下列叙述:①不能使酸性KMnO4 溶液褪色;②能使溴的四氯化碳溶液褪色;③不可溶于水;④可溶于苯中;⑤1mol苯乙烯最多能与4molH2发生加成反应;⑥所有的原子不可能共平面,其中正确的是
)有下列叙述:①不能使酸性KMnO4 溶液褪色;②能使溴的四氯化碳溶液褪色;③不可溶于水;④可溶于苯中;⑤1mol苯乙烯最多能与4molH2发生加成反应;⑥所有的原子不可能共平面,其中正确的是
A. ②③④⑤ B. ①②⑤⑥ C. ②③④⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到目的是( )
A.用焰色反应鉴別Na2CO3溶液和K2CO3溶液
B.用分液漏斗分离食醋中的乙酸与水
C.用丁达尔现象检验NaCl溶液中是否含有淀粉胶体
D.用NaOH溶液除去Cl2中混有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的金属铁与下列酸溶液反应,初始反应速率最快且最终产生氢气最多的是( )
A.100mL0.1mol/L盐酸
B.100mL0.2mol/L硝酸
C.75 mL0.2mol/L盐酸
D.20mL18.4mol/L硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com