
| A. | 稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ | |
| B. | 氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 碳酸钙溶于醋酸溶液中:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 澄清石灰水与稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O |
分析 A.稀硫酸和银不反应;
B.氧化铁与氢离子反应生成铁离子和水;
C.醋酸为弱电解质,离子方程式中不能拆开;
D.澄清石灰水写离子.
解答 解:A.稀硫酸和银不反应,故A错误;
B.氧化铁与稀盐酸混合,氧化铁与氢离子反应生成铁离子和水,其离子方程式为Fe2O3+6H+=2Fe3++3H2O,故B正确;
C.碳酸钙为难溶物,需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.稀盐酸和氢氧化钙反应生成氯化钙和水,澄清石灰水写离子,离子方程式为:H++OH-═H2O,故D错误;
故选B.
点评 本题考查离子方程式正误判断,题目难度不大,明确离子反应实质、离子性质是解本题关键,要掌握哪些物质写化学式、哪些物质写离子.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
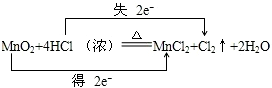 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2nmol-1 | B. | $\frac{n}{m}$mol-1 | C. | $\frac{2n}{m}$mol-1 | D. | nmol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)c(O{H^-})}}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com