
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
|
实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
|
1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
|
2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
|
3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
|
4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响,其规律是 。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸 改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是 。
(忽略温度对反应速率的影响)
(12分,每空2分)
(1)固体反应物的表面积; 增大固体反应物的表面积会加快化学反应速率
(2)1和3 (3)反应前溶液的温度; 3和4
(4)Cl- 对反应起促进作用(或 SO42-对反应起抑制作用)
【解析】
试题分析:影响化学反应速率的因素很多:固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越小,固体反应物的表面积越小,化学反应速率越慢;反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低。
(1)观察实验1和2,溶液的温度和稀硫酸的浓度均是相同的,但金属的表面积不同,由此可知实验1、2 表明固体反应物的表面积对反应速率有影响,其规律是增大固体反应物的表面积会加快化学反应速率。
(2)观察实验1和3,金属的质量和金属的状态,溶液的温度均是相同的,但稀硫酸的浓度不同,可知稀硫酸的浓度对反应速率有影响。
(3)观察实验3和4,金属的质量和金属的状态、稀硫酸的浓度均是相同的,但溶液的温度不同,所以该探究实验中,影响反应速率的因素还有反应前溶液的温度。
(4)在溶液中氢离子浓度相同的条件下,溶液中不同的是阴离子。进行实验3时,若将稀硫酸 改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快,这说明Cl- 对反应起促进作用(或 SO42-对反应起抑制作用)。
考点:考查影响化学反应速率因素的有关实验探究
点评:该题是中等难度的试题,也是高考中的常见题型,有利于培养学生规范严谨的实验设计能力,有助于提升学生的学科素养,提高学生的应试能力。该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| b-d |
| 16 |
| b-d |
| 16 |
| 16(d-a) |
| b-d |
| 16(d-a) |
| b-d |
查看答案和解析>>
科目:高中化学 来源: 题型:
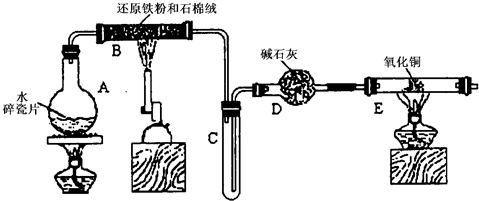
(12分)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。
(1)为了安全,加热E以前必须进行的操作是____________________________。
(2) B中发生反应的化学方程式是 _______________。
(3)已知有反应:Cu2O+2H+Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(4)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成。若反应后盛有药品的E的质量减轻了eg,F的质量增加了f g。水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= ________:_______;若反应后E中除Cu外还含有另一种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
(5)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜固体16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:___________(若为混合物,需计算出各自的质量)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省四地六校高一下学期第二次月考化学试卷 题型:实验题
(12分)某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 | 铁的质量/g | 铁的 形态 | V(H2SO4) /mL | c(H2SO4) /mol·L-1 | 反应前溶液 的温度/℃ | 金属完全消 失的时间/s |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
查看答案和解析>>
科目:高中化学 来源:2012届河北省三河一中高三上学期第二次月考化学试卷 题型:实验题
(12分)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。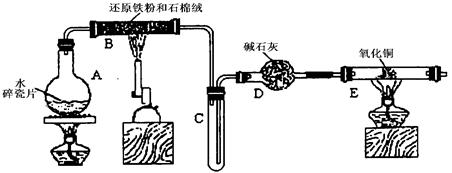
(1)为了安全,加热E以前必须进行的操作是____________________________。
(2) B中发生反应的化学方程式是 _______________。
(3)已知有反应:Cu2O+2H+ Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(4)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成。若反应后盛有药品的E的质量减轻了e g,F的质量增加了f g。水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= ________:_______;若反应后E中除Cu外还含有另一种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
(5)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜固体16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:___________(若为混合物,需计算出各自的质量)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com